O 原子半径(r) 通常、次のように定義されます 隣接する原子の2つの原子核間の距離の半分、下の図が表すように:

原子半径
原子半径は、周期表のファミリーと周期に応じて、原子ごとに異なります。 に属する要素に関して 同じファミリで、原子番号が増えると原子半径も大きくなります。、つまり上から下へ。 というのは、この意味で、ある原子から別の原子へとエネルギー準位または電子層が増加したため、その半径が比例して増加することを意味します。
要素に関して 同じ時期に、つまり、水平方向に 半径は右から左に、または原子番号が減少するにつれて増加します. これは、それらがすべて同じ数のレイヤーを持っているためです。違いを生むのは、 これらの層の電子、および電子が多いほど、原子核への引力が大きくなるため、原子核の半径が小さくなります。 原子。

周期表の家族と期間に応じた原子半径の成長方向
ただし、原子半径は、確立された接続によって異なる場合があります。 これがどのように発生するかを見てみましょう。
*イオン結合: 原子が形成する場合 陽イオン、原子半径が減少します、1つまたは複数の電子を失うため、原子核は電子をより強く引き付けます。 今なら 陰イオンを形成する、つまり電子を獲得すると、原子の半径が大きくなります、エレクトロスフィアの総電荷は原子核の総電荷よりも大きくなり、その引力が減少するためです。 獲得または喪失する電子が多いほど、ビームのサイズの変動が大きくなります。
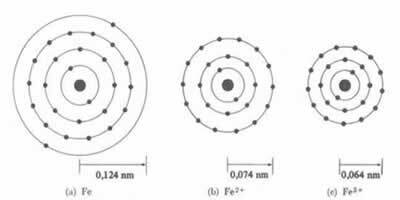
陽イオンの直径または半径は、常に原子の直径または半径よりも小さくなります
また、一連の 等電子イオン、電子の量とエネルギーレベルが同じである場合、原子番号が最小のイオンの半径が大きくなります。 たとえば、イオン 13アル3+, 12mg2+, 11で1+, 9F-1, 8O2- そして 7N-3、すべてに10個の電子と2個の電子レベルがあります。 しかし、最大の半径を持っているのは 7N-3、原子番号が最小(Z = 7)であるため。
*共有結合: 2つの原子が共有結合を作るとき、 2つの原子が等しい場合、水素ガスの場合のように(H2), 結合半径(r)は、結合の長さ(d)の半分、つまり2つの原子核を隔てる距離の半分であると言えます。. しかし、 結合が異なる原子によって作られている場合、塩化水素(HCl)の場合のように、 長さまたは距離(d)は、共有結合に関与する原子の共有結合半径(r1 + r2)の合計になります。
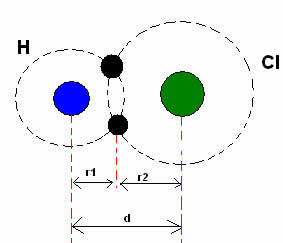
共有結合の原子半径の合計。
もちろん、原子の共有結合半径は他の異なる原子と結合するときに変化する可能性があるため、この問題ははるかに複雑であることを覚えておく必要があります。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm
