THE 自動酸化還元または不均化反応 同じ化学元素が受ける酸化還元反応の一種です 酸化 と削減。 このタイプの反応の2つの例と、レドックス法を使用してそれらのバランスをとる方法を見てみましょう。
最初の例:
で2- + H+ →いいえ3- + NO + H2O
- 反応に関与するすべての原子とイオンの酸化数(NOX)を計算することにより、誰が酸化し、誰が反応したかを確認できます。
+3 -2 +1 +5 -2 +2 -2 +1 -2
で2- + H+ →いいえ3- + NO + H2O
- 窒素は反応と酸化の両方を行った種であることに注意してください。
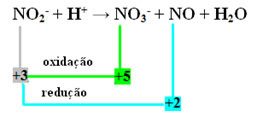
- 酸化還元によるこの反応のバランスをとるには、NOXを試薬ではなく生成物に関連付ける必要があります。
で3- = ∆Nox = 5-3 = 2
NO = ∆Nox = 3-2 = 1
- 係数でΔNOXを反転すると、次のようになります。
で3- = ∆NOX = 2 → 2 NOの係数になります
NO = ∆NOX = 1→ 1 NOの係数になります3-
で2- + H+ → 1 で3- + 2 NO + H2O
- これにより、積に3 Nが含まれていることがすでにわかっているので、NOの係数は2- 3になります:
3いいえ2- + H+ →1いいえ3- + 2 NO + H2O
- Hの係数を決定するには+ とHから2O、受け取った電子の数は、寄付した電子の数と同じであることを忘れないでください。 したがって、試薬の電荷は製品の電荷と等しくなります。 このようにして、次のスキームを作成できます。
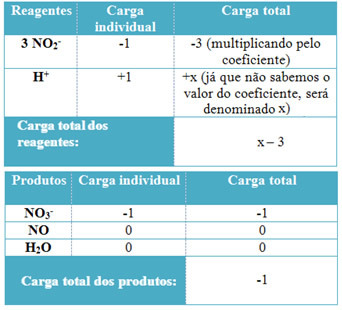
この情報に基づいて、試薬の総電荷は次のようになります。 x – 3 そして積は等しい -1. 述べたように、2つの料金は等しくなければなりません。 製品の総負荷はすでにあるので、簡単な計算を実行して、xの値がどうなるかを知ることができます。
x -3 = -1
x = -1 +3
x = 2
したがって、Hの係数+ は2であり、その結果、Hの21になります:
3いいえ2- + 2 H+ →1いいえ3- + 2 NO + 1 H2O
2番目の例:
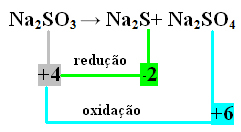
この場合、還元と酸化を同時に行ったのはSでした。 したがって、以前に行ったように、NOXを製品に関連付け、それらの値を反転して、係数を製品に割り当てることができます。
で2 S = ∆Nox = 4 –(-2)= 6 → 6 Naの係数になります2 のみ4
で2 のみ4= ∆Nox = 6-4 = 2 → 2 Naの係数になります2 s
で2 のみ3→ 2 で2 Y + 6 で2 のみ4
第2肢には8つの硫黄があるため、Na係数2 のみ3 8になります:
8インチ2 のみ3→2で2 S +6インチ2 のみ4
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm

