Lorenzo Romano Amedeo Carlo Avogadro(1776-1856)は、イタリアの化学者であり、 原子質量に数値的に等しいグラム単位の質量を持つ元素のサンプルは、常に同じ数の原子を持っています (N)。
Avogadro自身はNの値を決定できませんでした。 しかし、20世紀を通じて、技術と科学的知識の進歩により、他の科学者がそれを決定するための技術を開発することが可能になりました。 この値が最終的に発見されたとき、それは呼ばれました アボガドロ定数、この科学者に敬意を表して、その創造の基礎を築いたのは彼でした。

ロレンツォロマーノアメデオカルロアボガドロ(1776-1856)
1モルのエンティティ(原子、分子、電子、式、またはイオン)には、アボガドロ定数の値が正確に含まれています。
以下の表は、20世紀を通じて得られたアボガドロ定数のいくつかの値を示しています:
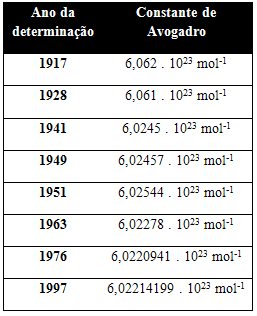
アボガドロ定数の値を決定するために使用される手法のいくつかを次に示します。
アボガドロ定数の近似計算を行った最初の科学者は、ヨハン・ジョセフ・ロシュミットでした。 1867年、彼は気体の運動論に基づいて、1cmに存在する分子の数を決定しました。3 ガスの。
これらの科学者のもう1人は、懸濁液中の単位体積あたりのコロイド粒子の数を数え、それらの質量を測定したフランス人のジャンバプティストペラン(1870-1942)でした。 彼が見つけた値は6.5から7.2の間でした。 1023 モルあたりのエンティティ。 この科学者は1913年に本を出版しました レ・アトメス (第1版 Paris:Alcan)、および1924年に発行されたその第9版には、アボガドロ定数を実験的に取得するための16の方法が含まれていました。

ジャン・バプティスト・ペラン(1870-1942)
数年後、科学者のジェームズ・デュワー(1842-1923)は、放射化学者のバートラム・ボルトウッド(1870-1927)と物理学者のアーネストによって数年前に開発された方法を使用しました。 ラザフォード(1871-1937)は、基本的に、放射線源から放出されたアルファ粒子を数え、得られたヘリウムガスの量を測定することで構成されていました。 デュワーが見つけた値は6.04でした。 1023 モル-1.
20世紀に戻ると、ロバートミリカン(1868-1953)は、電子の電荷(1.6。 10
-19 Ç)。 1モルの電子の電荷はすでに知られているので(96500 C)、これら2つの値を関連付けて、アボガドロ定数の次の値を見つけることができました:6.03。 1023 モル-1.現在、アボガドロ定数の推奨値は 6.02214 x 1023 モル-1 そしてそれは、サンプル中の1モルの原子の密度と質量がわかっている限り、結晶格子の数個の原子の体積が得られるX線回折によって決定されます。
教訓的な目的で、化学実験室で実行される計算ほど正確である必要がない高校では、アボガドロ定数は次のように見なされます。 6,02. 1023 モル-1.
学生が実際にアボガドロ定数を決定するのを助けるために使用できるより簡単な方法もあります。 1つは、水性媒体中での電気分解によるものです。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm
