日常生活や実験室では、自発的な反応や変化があり、自発的ではないものもあります。 たとえば、すべての燃焼は自発的な反応です。これは、一度開始すると、すべての燃料が消費されるか、すべての酸素がなくなるまで継続するためです。
一方、電気分解は、電気エネルギーが化学エネルギーに変換される非自発的なプロセスです。 例として、塩化ナトリウム(NaCl)の電気分解があります。 この溶融塩に電流を流すと、酸化還元反応と金属ナトリウム(Na)の生成が起こります。(s))および塩素ガス(Cl2(g)). 電流を流すのをやめると、反応は自然に続きません。これは、それが自発的ではないことを示しています。
反応の自発性は、 ギブズヘルムホルツ方程式、 下記のとおり:

何の上に:
∆G =自由エネルギーの変動。
∆H =エンタルピーの変化;
T =ケルビン単位の温度(常に正)。
∆S =エントロピーの変化。
この方程式は、アメリカの物理学者Jによって提案されたため、その名前が付けられています。 ウィラードギブス(1839-1903)とドイツの物理学者ヘルマンヘルムホルツ(1821-1894)による。
この方程式が反応の自発性を決定するのにどのように役立つかをよりよく理解するために、それに含まれる各概念を簡単に確認しましょう。
- ∆H(エンタルピー変動): エンタルピー(H)は、物質のエネルギー量です。 これまでのところ、それを決定する方法は知られていません。 実際には、熱量計を使用して、プロセスのエンタルピー変動(ΔH)を測定することが達成されます。 この変動は、 その過程で放出または吸収されたエネルギー.
- ∆S(エントロピー変動):エントロピー(S)は、システムの無秩序度を測定する熱力学的量です。
たとえば、氷が溶けると、分子は固体から液体の状態に移行します。 これは、このプロセスでエントロピーが増加したことを意味します(∆S> 0)。
アンモニア(NH3)、1molの窒素ガスが3molの水素ガス(つまり、反応物中の4 molの分子)と反応して、2molのアンモニアを生成します。
N2(g) +3 H2(g) →2NH3(g)
この過程で気相中の分子数が減少するため、崩壊が減少し、これはエントロピーも減少したことを意味します(ΔS<0)。
- ∆G(自由エネルギー): 自由エネルギーまたは ギブズの自由エネルギー (1878年にこの科学者によってのみ提案されたため) 仕事をするために使用されるシステムの有用なエネルギー。
システムにはグローバルなエネルギーがありますが、そのエネルギーのごく一部だけが仕事に使用されます。これはギブズの自由エネルギーと呼ばれ、 G.
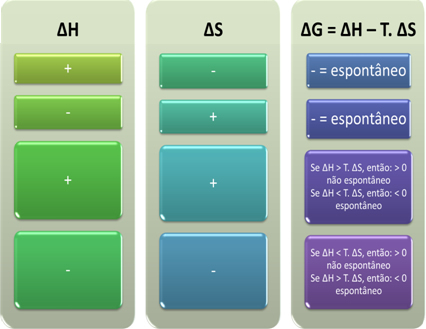
ギブスによると、 プロセスが作業を実行する場合、つまりGが減少する場合、プロセスは自発的であると見なされます。. この場合、変換の最終状態は、ΔG<0のときに初期状態よりも安定します。
これに基づいて、次のように結論付けることができます。

また、ギブズヘルムホルツ方程式のΔHとΔSの代数的符号を調べることで、プロセスが自発的であるかどうかを確認できます。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
