ハイブリダイゼーション理論は、 オクテット理論、ホウ素(B)によって形成された分子を含む多数の分子の構造を説明することに成功しました。
この元素には、次の電子配置を持つ5つの基底状態の電子があります。
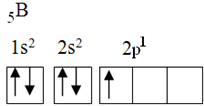
オクテット理論によると、ホウ素は不完全な原子軌道を1つしかないため、共有結合を1つしか作ることができませんでした。 ただし、実験的には、この元素が複数の結合を行う化合物を形成することに注意してください。
例は三フッ化ホウ素(BF3). 以下に示すように、ホウ素はフッ素と3つの共有結合を形成し、 電子とその最後のシェル(原子価層)に6つの電子を持っている、すなわち、の規則の例外 オクテット。
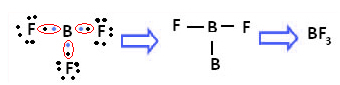
これは、ホウ素で発生する混成現象によって説明されます。 サブレベル2sからの電子がエネルギーを吸収して励起状態になり、サブレベル2pから空の軌道にジャンプすることがわかります。 このようにして、3つの不完全な軌道が形成され、3つの共有結合を形成できるようになります。
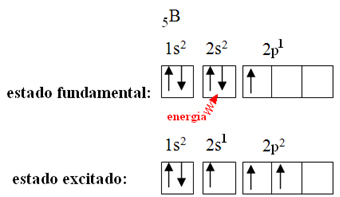
ただし、三フッ化ホウ素で形成される結合はすべて同じですが、上を見ると2つの結合があります それらの1つはs軌道を介して作成され、他の2つはタイプの軌道を介して作成されるためです。 タイプp。 これは、混成が行われる場所です。つまり、不完全な軌道が合流し、3つが発生します。 ハイブリッド軌道 または ハイブリダイズ, オリジナルと同一で異なるもの:
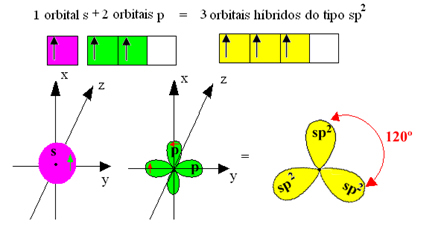
これらの混成軌道は1つのs軌道と2つのp軌道で構成されているため、この混成軌道は sp²ハイブリダイゼーション。
ホウ素に結合するフッ素には9つの電子があります。 その電子分布と軌道を以下に示します。
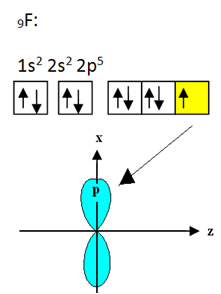
各フッ素原子は1つの共有結合しか作成できず、この結合を作成する軌道はタイプpであることに注意してください。 したがって、BFを形成する接続を行うときに、軌道がどのように形成されるかを以下で観察します。3 リンクがどのように同一であるかを確認します。 σp-sp2:
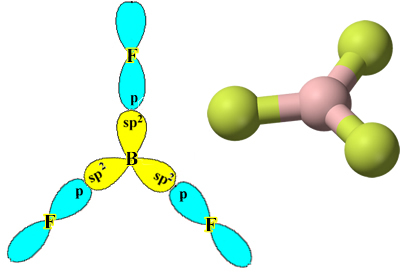
これは他の要素でも発生します。たとえば、「ベリリウムハイブリダイゼーション。”.
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm
