科学者フリードリッヒ・コールラウシュ(1840-1910)は、小規模ではありますが、純水が電気を通すと最初に提案しました。 これは、水が両性的に振る舞うためです。 つまり、特定の場合には、酸のように作用し、プロトンを提供します(H+); また、プロトンを受け取る塩基のように振る舞うものもあります。
これは、以下に示す化学反応式に従って、水が独自のイオン化を実行することを意味します。
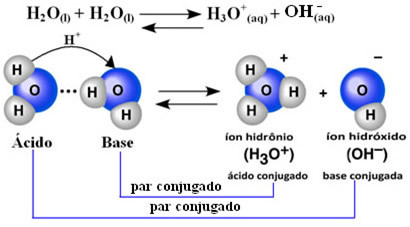
このプロセスはと呼ばれます 水の自動イオン化 そしてそれは非常に小規模で発生します、つまり、水は非常に弱い電解質であり、イオン化の程度と平衡状態でのイオン化定数の値が低くなります(Kç). これがまさに水がそのような低い導電率を持っている理由です。
アイデアを得るために、25°Cの周囲温度で、純水の自己イオン化で生成される水酸化物とヒドロニウムイオンの濃度が1に等しいと決定することが可能です。 10-7 モル。 L-1. これは、10億の水分子のうち、2つだけがイオン化することを意味します。
水のイオンバランス定数はと呼ばれます ç水解離定数、自動プロトン分解定数または 水のイオン積.この定数は次の式で表されます。 Kw、wは単語を参照しているため 水、これは英語で水を意味します。
その計算は、他の平衡定数と同じ方法で行われ、テキスト「定数 この場合、液体状態の水は同じ活性を持っているため、製品のみが式に表示されます。 1に。 純粋な液体または固体の物質は変化しないため、解離定数の表現には含まれません。 水溶液と気体の溶液のみが配置されます。 だから私たちは持っています:
Kw = [H3O+]. [ああ-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
他の平衡定数と同様に、 OKw 温度の変化によってのみ変化します。 水の温度が上昇すると、そのイオン化も増加します。つまり、水の自己イオン化は吸熱プロセスです。つまり、熱を吸収します。
これは、水のイオン積(Kw)さまざまな温度で下の表に示されています:
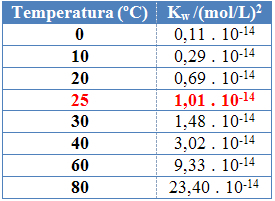
水のイオン積は、純水であろうと溶液であろうと、各温度で常に固定値を持ちます。 溶液にHイオンの濃度があっても3O+ そしてああ- 異なると、それらの間の積は一定のままになります。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm
