O ジルコニウム、記号Zr、原子番号40は、のグループ5に属する化学元素です。 周期表. 耐食性に優れ、熱安定性にも優れています。
要素は 化学的に非常に似ています ハフニウム、そしてこのため、すべての天然ジルコニウムサンプルは少量のハフニウム含有量を持っています。 地殻に豊富に含まれており、銅、亜鉛、鉛などの広く使用されている元素よりもはるかに高い含有量です。
ジルコニウムは 原子力産業における幅広いアプリケーション、その低い中性子吸収により、二酸化ウランが豊富な燃料の優れたコーティングになります。 さらに、毒性がなく、生体適合性が非常に高いと考えられているため、ジルコニウムは外科用プロテーゼやインプラントに使用されています。
あまりにも読んでください: ウラン—エネルギー生成にとって非常に重要な元素
ジルコニウムについてのまとめ
ジルコニウムは 金属 周期表のグループ5に属しています。
これらの元素は化学的に非常に類似しているため、ハフニウムの含有量が少ない自然界では常に現れます。
ジルコナイトとバデライトが主なジルコニウム鉱石です。
ジルコニウムとハフニウムの分離は非常に困難です。
ジルコニウムは優れた耐食性と耐高温性を備えています。
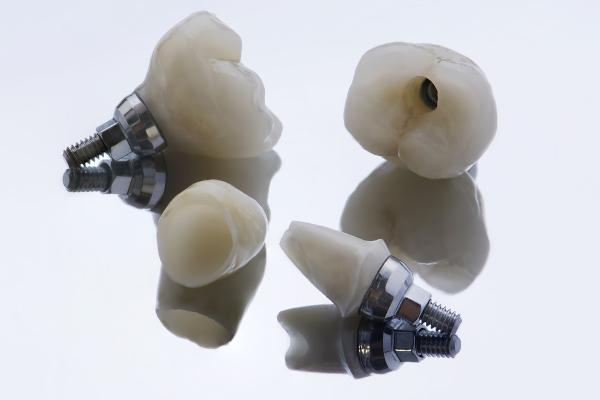
毒性がなく、生体適合性が高いため、歯科インプラントやその他の補綴物に使用できます。
ジルコニウムの多くは原子力産業で使用されています。
この元素は、1789年にドイツの科学者マルティンクラプロスによって発見されました。
ジルコニウムの特性
シンボル:Zr。
原子番号: 40.
原子質量:91.224 c.m.u.
電気陰性度: 1,33.
融点:1855°C。
沸点:4409°C。
密度:6.52 g.cm-3 (20°Cで)。
電子配置:[Kr] 5秒2 4d2.
化学シリーズ:グループ4、遷移金属。
今やめないで... 広告の後にもっとあります;)
ジルコニウムの特徴
ジルコニウムは、その金属の形で、 灰色がかった金属 主にZrO層のために優れた耐食性を持っています2 それはその周りに形成され、内部の金属塊を保護します。 ただし、ジルコニウムを細かく分割すると、自然発火性が高くなります。つまり、特に高温では、空気と接触すると自然発火する可能性があります。
化学的には、ジルコニウムはハフニウムに非常に近いです。特に、元素が自然界で一緒に発生するためです。 したがって、ハフニウムのように、ジルコニウム からの化学的攻撃を受けません 酸 希釈 (HFを除く)加熱されない限り。 アルカリ性溶液は、高温であっても、ジルコニウムに対してあまり効率的ではありません。
高温システムでは、ジルコニウムはほとんどの物質と反応する能力があります 非金属. 反応すると、ZrOの場合と同様に、酸化数+4のジルコニウム化合物が最も安定していることがわかります。2 またはZrCl4. +3などのより低い酸化状態は安定性が低く、 チタン、グループ4で最も軽い元素で、この荷重に対して良好な安定性があります。
ジルコニウムはどこにありますか?

周期表のdブロック元素の中で、ジルコニウムは4番目に豊富で、後ろにあります 鉄、チタンと マンガン. それらは存在します の詳細 30 私が持っている鉱石とmその構成のジルコニウム. 最もよく知られていて最も重要なものの中には、ジルコン(ジルコンとしても知られている)、ZrSiO4、およびバデライト(またはバデライト)、ZrOがあります。2. バデライトはブラジルでも見られます。
ジルコニウムの埋蔵量が最も多い国は、オーストラリア、南アフリカ、モザンビークです。 ただし、最大の生産国は中国、フランス、インド、ロシア、ドイツ、米国です。
興味深いことに、ジルコニウム 中には豊富にあります 出演者. 要素はでさえ識別されました 太陽 そして隕石で。 アポロ計画を通じて得られた月のサンプルは、ZrOの含有量が高いことを証明しました2 陸生のものと比較したとき、これらの岩で。
も参照してください: 金—優れた導電性で際立っている貴金属
ジルコニウムの入手
ジルコニウム ハフニウムで自然に発生します、常に2番目の元素の含有量が1〜3質量%の範囲で変化します。 含有量が少ないにもかかわらず、2つの間の分離は非常に困難です。
一般的に、クロール法はジルコニウム抽出に使用されます。 このプロセスでは、ZrO2 鉱石に含まれるものは、高温でZrClに変換されます4. このようにして、還元剤としてマグネシウムを使用してジルコニウムを得ることができる。 次の反応は、プロセスを示しています。
ZrO2 →ZrCl4 (CClを使用4 770 Kの温度で)
ZrCl4 →Zr(1420 Kの温度のAr雰囲気でMgを使用)
ただし、ZrとHfの化学的類似性が高いということは、ハフニウムが永続的な不純物として最終システムに残ることを意味します。 したがって、 ZrとHfを分離するための冶金技術の使用. 業界はすでに湿式製錬(すなわち、水溶液中で発生する)および乾式製錬(水の存在なし)ルートを開発しています。
湿式製錬技術は、K塩の分別結晶作用です。2ZrF6 とK2HfF6、水への溶解度は同じではありません。 別の解決手法は、ZrおよびHf化合物を溶解する溶媒抽出です。 水中でメチルイソブチルケトンなどの有機溶媒で選択的に抽出し、 賛辞。 分離の難しさを考えると、市販のジルコニウムは通常、Hfの1〜3質量%の含有量で販売されています。
ジルコニウムの用途
金属ジルコニウムは で採用 リーグ、主に鋼で、機械的および耐食性の点でそれらをより良くするために。 高温での金属の安定性はまたそれがすることを可能にします 宇宙船で使用、地球の大気圏への再突入中に遭遇する極端な条件のために多くの損害を被ります。
ジルコニウムは、優れた生体適合性に加えて、非毒性で耐食性の高い元素として認識されているため、 外科的用途での使用も検討されています、歯科補綴物やインプラントのように。

二酸化ジルコニウム、ZrO2は、2500°Cの範囲で非常に高い融点を持っています。 したがって、それはで使用されます 耐熱性の高い容器の製造、高耐性セラミックに加えて。 このため、これらのセラミックは切削機械にも利用されています。 ZrO2 また、化粧品、制汗剤、食品包装、さらには偽の宝石にも使用できます。
ジルコニウムの多くが 原子力産業. たとえば、Zリーグがありますircaloy®、核目的のためだけに開発されたジルコニウムとスズの金属合金。
原子力産業では、ジルコニウムは を含む包装に使用ê酸化ウラン、の燃料 発電所. それは水に対して非常に耐性があり、捕獲が少ないためです 中性子、それはこの目的のための良い材料であることがわかります。 中性子は 核分裂、したがって、ジルコニウムがそれらを捕捉しないことが不可欠です。 捕捉されないため、ジルコニウムは表示されません 放射能. そのため、この場合、ジルコニウムは、中性子を捕獲する優れた能力を持つ金属であるハフニウムの痕跡を残すことができません。
ポッドキャストでチェックしてください:原子力発電所はどのように機能しますか?
ジルコニウムの歴史
ジルコニウムという名前はおそらく由来しています サルゴン、現在ジルコニアとして知られている宝石の色を説明するために使用されるシリア語からの単語。 鉱物はすでに知られていましたが、それらが新しい元素を含んでいることは知られていませんでした マルティン・ハインチ・クラプロスは、1789年に、ベルリンで元素を検出することに成功しました。. ドイツの科学者は元素に名前を付けることにしました ジルクホーン。
1789年はクラプロスにとって非常に重要でした。同じ年に科学者がウラン元素を発見したからです。
ジルコニウムに関する解決済みの演習
質問1
(FGV SP / 2014-適応) 新しい有望なクラスの超電導材料は、化合物の二ホウ化バナジウムジルコニウムに基づいています。 この化合物は、ジルコニウム(IV)塩から合成されます。
(雑誌 検索Fapesp、 2013年6月。 適合しました)
Zrイオンの陽子と電子の数4+ それぞれに等しい:
A)36; 40
B)40; 40
C)40; 44
D)40; 36
E)36; 36
返事
文字D
ジルコニウムが持っているように 原子番号 40に等しい場合、その数は 陽子 原子番号は陽子の数と数値的に等しいため、も40です。
+4に等しい電荷を提示すると、この形式のジルコニウムには4つあることがわかります。 電子 ニュートラルな形でない限り。
中性の場合、陽子の数は電子の数に等しくなります。つまり、元々ジルコニウムには40個の陽子と40個の電子があります。 4つの電子を失い、ジルコニウムは36だけ残っています。
質問2
(Uerj 2013 —適合しました) 二酸化ジルコニウムは、炭素の同素体であるダイヤモンドに似ており、低価格の宝飾品の代わりに使用できます。
二酸化ジルコニウムの化学式、およびこの物質の原子間結合のタイプを含む代替物をマークします。
A)ZrO4、共有。
B)ZrO2、イオン。
C)ZrO2、共有。
D)ZrO4、イオン。
E)ZrO2、メタリック。
返事
文字B
二酸化ジルコニウムは、その名前が示すように、2つの原子のみを含む必要があります 空気. したがって、期待される式はZrOです。2. さらに、ジルコニウムは通常、+ 4に等しい酸化状態を獲得します。
原子間結合の種類は イオン性、2つの理由:
ジルコニウムは金属であり、酸素は非金属です。
の違い 電気陰性度 両方の間が1.7より大きい(3.5 – 1.3 = 2.2)。
StefanoAraújoNovais著
化学の先生