THE 異性 これは、同じ種類の原子が同量で異なる化合物が形成されるときに観察される現象です。
したがって、分子式が同じで、構造式や空間配置が異なる化学物質を見つけることができます。
この現象は、炭素化合物を研究する有機化学で広く見られます。 この元素の各原子は4つの化学結合を作ることができるので、異なる組み合わせを観察することが可能です。
原子の配置の変化が新しい物質を生み出すので、結果として、それらは異なる物理的および化学的性質を持っています。
どの化合物が 異性体 単語はギリシャ語起源の2つの用語の組み合わせであるため、それらは等しい部分を持っていることを意味します。 isos、は「本当に」を意味し、 ほんの、これは「パーツ」です。
異性化の2つの主要なグループは、平面と空間(立体異性)です。
THE フラット異性 化合物のフラットな構造式で視覚化でき、位置、機能、連鎖、補償、互変異性の5つのクラスがあります。
THE 空間異性 それは化合物の配向によって観察され、幾何(シス-トランス)と光学に細分されます。
異性化の概念は、1830年にスウェーデンの科学者ジェイコブベルセリウスによって導入されました。
異性体の例
THE 鎖異性 これは、同じ原子のセットが接続して同じ官能基の構造を形成するときに発生しますが、鎖は異なります。
例:分子式C4H10 炭化水素のは、直鎖または分岐状にすることができます。

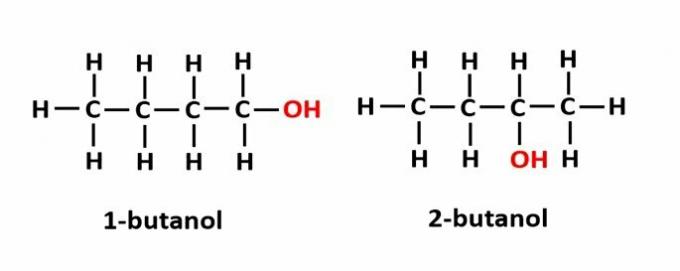
THE 位置異性 化合物が同じ官能基によって形成されているが、鎖の異なる位置にある場合に発生します。
例:分子式C4H9OHは2種類のアルコールに相当します。
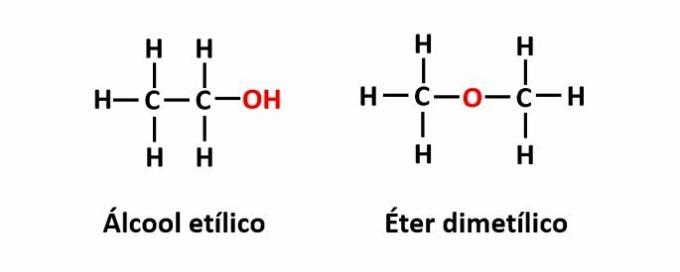
THE 機能異性 同じ分子式が異なる官能基を持つ2つの化合物に対応する場合に発生します。
例:分子式C2H6Oは、アルコール(-OH)とエーテル(-O-)の機能を持つ2つの異性体に対応します。
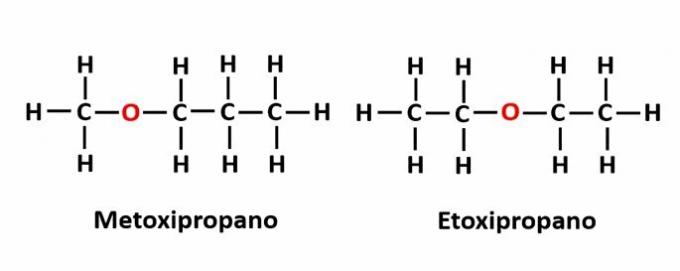
THE 補償異性 チェーン内にヘテロ原子があり、異なる位置を占める場合に発生します。 これは、位置異性の特定のケースです。
例:分子式C4H10は鎖に酸素原子が存在することを示しますが、その位置が変化してさまざまな化合物を形成する可能性があります。
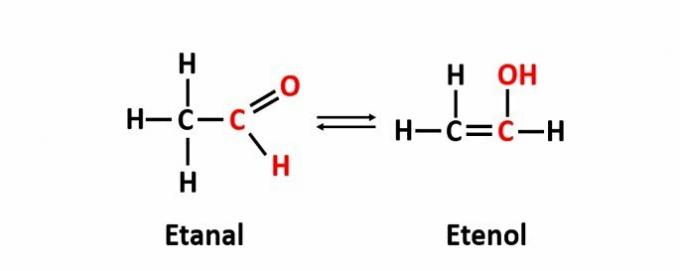
THE 動的異性互変異性とも呼ばれ、機能の異なる2つの化合物が動的平衡状態の同じ溶液にある場合に発生します。 これは、関数異性の特定のケースです。
例:分子式C2H4Oは、アルデヒドおよびエノール機能を持つ化合物に対応します。
詳細については フラット異性.
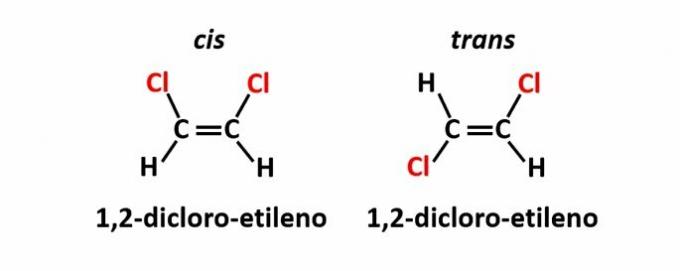
THE 幾何異性、異性とも呼ばれます シス-トランス、二重結合または環状構造の存在により、等しい配位子が平面の同じ側にある場合に発生します(シス)または反対側(トランス).
例:分子式Cの化合物の塩素原子2H2Cl2 それらは2つの空間構造を持っているかもしれません。
THE 光学異性 構造物に放出された偏光を偏向させるときに、化合物がビームを偏向させることができたときに発生します 左回転(l)異性体の場合は左に、右回転異性体の場合は右に発光します。 (d)。
例:このタイプの異性化は乳酸で発生します。 以下では、異性体のスペクトル画像が重ならないため、エナンチオマーと呼ばれることに注意してください。
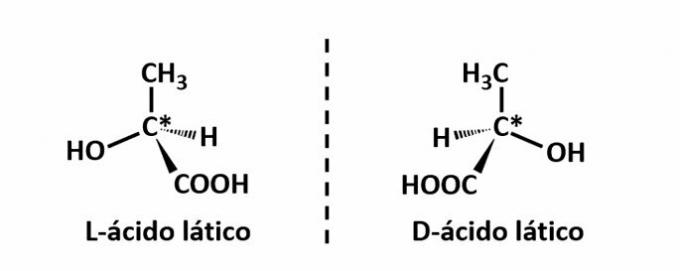
記号C *は、この構造にキラル炭素が存在すること、つまり4つの異なるリンカーを持つ炭素原子が存在することを示します。
内容による異性化の詳細:
- 異性の種類
- 空間異性体
- 幾何異性体
- 光学異性体
- 平面異性に関する演習



