THE 反応の速度の法則 化学変換の速度を物質量(mol / L)で表した試薬の濃度と関連付けます。これは、次のように表すことができます。

たとえば、次の一般的な反応について考えてみます。
aA + bB→cC + dD
反応物AとBの濃度を上げると、反応の速度はどうなりますか? さて、反応物粒子の量が同じ空間で増加するにつれて、それらの間のより効果的な衝突があり、それは反応発達の速度の増加をもたらすでしょう。 それはそれがあなたの速度を上げることを意味します。
したがって、反応速度は反応物の濃度に正比例します。 ただし、温度にも依存します。 したがって、反応速度の法則を表す次の数式があります。

何の上に:
v =反応速度;
k =温度値のみに依存する定数。
αおよびβ=実験的に決定された指数。
反応が素反応である場合、つまり単一のステップで発生する場合にのみ、指数は平衡化学反応式の係数に正確に等しくなります。 v = k。 [THE]ザ・. [B]B. ただし、他の場合では、各試薬の濃度を上げる必要がある適切な効力を実験的に決定する必要があります。
今やめないで... 広告の後にもっとあります;)
反応速度の法則には多くの名前があります。ここにいくつかあります。 質量作用の法則、速度方程式、反応の速度論的法則、およびGuldberg-Waage法則。
この法律を適用する方法の例を考えてみましょう。
次の素反応を考えてみましょう。
2 HCl (g) →H2(g) + Cl2(g)
a)この反応の速度の方程式を書きます。
b)実験を通じて、25°Cの一定温度でのこの塩化水素ガス分解反応の速度とこの試薬の濃度を以下の表に示しました。
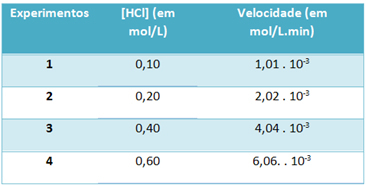
これに基づいて、上記の温度でのこの反応の特徴的な速度定数を決定します。
解決:
) v = k。 [HCl]2
b)v = k。 [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 モル。 L-1. 分-1
0.01モル。 L-1
k = 1.01。 10-1 分-1
文字「b」を解くために、得られた値が同じになるという任意の実験のデータを使用できます。
しかし、反応が初歩的でない場合はどうなりますか? 素反応以外でこのような問題を解決するにはどうすればよいでしょうか。 方法を見つけるには、非素反応の速度の法則を読んでください。
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "化学反応の速度の法則"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. 2021年6月27日にアクセス。



