NS エンタルピー は熱力学的関数であり、 等圧プロセスに含まれる熱を計算しますつまり、一定の圧力下に保たれます。 その発展は、カロリック説の崩壊直後に起こり、 熱力学 1840年から1850年の間。
エンタルピー、 何ウミカ、それが絶対的で孤立した値として機能する場合はあまり意味がありませんが、 化学プロセスにおけるその価値の変動. プロセスのエンタルピー変動を計算する方法はいくつかありますが、主な方法は、形成、結合、および そこのちょっとヘスから.
あまりにも読んでください: ギブズの自由エネルギーとは何ですか?
エンタルピーのまとめ
エンタルピーは、一定の圧力で発生するプロセスに含まれる熱を計算するための熱力学的ツールです。
それはアメリカの物理学者JosiahWによって定義されました。 カロリック説の崩壊という文脈でのギブス。
化学では、常にΔHで表されるエンタルピー変化を使用します。
熱を吸収する化学反応は吸熱反応と呼ばれ、ΔH> 0です。
熱を放出する化学反応は発熱と呼ばれ、ΔH<0です。
エンタルピーに関するビデオレッスン
エンタルピーとは何ですか?
常にHで表されるエンタルピーは、最初は アメリカの物理学者ジョサイアウィラードギブスによって定義されました、彼は定圧関数での熱と呼んでいます。なぜなら、彼の言葉では:
「[…]機能の低下は、圧力が変化しないすべての場合において、システムによって放出される熱を表しています。」
今やめないで... 広告の後にもっとあります;)
ギブスの仕事から、エンタルピーは熱力学的関数として理解できます。 変動は、システム内で交換される熱量に数値的に等しくなります。 プレッシャー 絶え間ない. これは、(ほとんどの化学プロセスのように)等圧プロセスでは、知っていることを意味します エンタルピー関数の変動を計算すると、システムとの間で交換される熱の値を知ることができます。 近所。

このような熱との相関関係が原因 多くの学生は、エンタルピーはと同義であると誤って考えています 熱 または、エネルギー量、熱量、放出熱および吸収熱などのようなもの。
エンタルピーは、熱を暖かい体から冷たい体に移される不可思議な物質として扱ったカロリック説の崩壊の文脈で生じました。 したがって、熱を計算するための新しいツールが必要でした。 したがって、解決策は、エンタルピーなどの熱力学方程式をすでに定義している量を使用することでした。
あまりにも読んでください: 溶液のエンタルピー変化を計算する方法は?
エンタルピー変動
エンタルピーは化学プロセスで交換される熱を計算するために使用されるツールであるため、絶対的な孤立した数値として使用することは意味がありませんが、 その変動を考慮すると、つまり実際には、熱力学によってエンタルピーがどの程度変化したかを数値的に評価する必要があります。 バリエーションは プロセスで放出または吸収される熱に数値的に等しい.
厳密に言えば、エンタルピーの変動は次のように定義できます。
ΔH= H最後の - NSイニシャル
化学プロセスと同様に、最終ステップは製品と見なすことができ、最初のステップは試薬と見なすことができます。 エンタルピー変動の定義を次のように見ることも一般的です。
ΔH= H製品 - NS試薬
実用的かつ解釈的な観点から、 エンタルピーの変化が正の場合(ΔH> 0)、化学反応は 吸熱つまり、プロセス全体で熱が吸収されます。 すでに エンタルピーの変化が負の場合(ΔH< 0)、化学反応は 発熱つまり、プロセス全体で熱が放出されます。
次の例に示すように、多くの場合、エンタルピーの変動はグラフで観察されます。
例1:
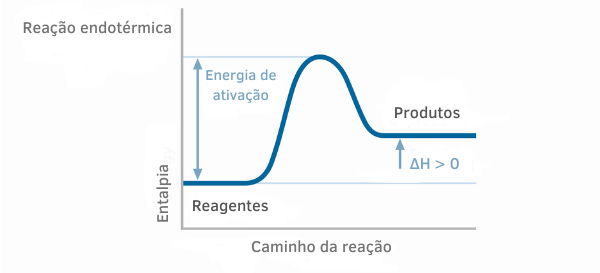
吸熱反応チャート
吸熱反応のエンタルピーグラフでは、生成物のエンタルピー量が反応物のエンタルピー量よりも大きいことがわかり、反応に沿った変動が正であることを示しています。 したがって、ΔH> 0の場合、化学プロセスは熱吸収で発生したと言えます。
例2:
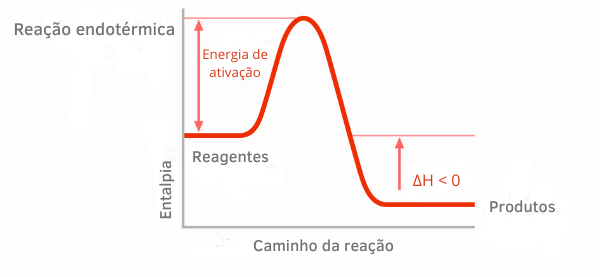
発熱反応チャート:
発熱反応のエンタルピーグラフでは、生成物のエンタルピー量が反応物のエンタルピー量よりも小さいことがわかり、反応に沿った変動が負であることを示しています。 したがって、ΔH<0であるため、化学プロセスは熱の放出とともに発生したと言えます。
テキストで化学反応のこれらの分類についてもっと読む: にとって吸熱および発熱プロセス.
エンタルピーの種類
生成エンタルピー
NS 生成エンタルピー é 計算された に基づく 形成化学反応、これは、室温および1気圧で最も安定した単純な物質から1モルの化合物が形成される反応です。
NS2(g)+½O2 (g)→H2O(l)H°NS = -286 kJ / mol
生成エンタルピーの大きな利点は、室温および1気圧でより安定している単純な物質のエンタルピーがゼロに一致することです。 これは、それらが実際にゼロであるということではありませんが、単純化とより良い分類のために、これらはこのように扱われます。
であること NS = H製品 - NS試薬、考えれば、そのH試薬 = 0、ΔHの観測値は、これらの場合、常に1モルの複合物質である生成物にのみ関連していると言えます。 したがって、この値を、ΔH°で表される水の生成の標準エンタルピー変動として表にします。NS.
いくつかの物質がそれらのバリエーションを持っていたのはこの方法論でした 標準エンタルピー 以下に示すように、フォーメーションテーブル。
物質 |
生成エンタルピー(ΔH°NS)kJ / molで |
CO2 (NS) |
-393,4 |
CaO(s) |
-634,9 |
HI(g) |
+25,9 |
いいえ(g) |
+90,1 |
結合エンタルピー
結合エンタルピーは、特定のモルの破裂または形成に関与するエネルギーの量を示すのに役立ちます。 化学結合.
理解されている、 化学結合を切断するには、熱を吸収する必要があります、結合原子がそれらを増加させるように 内部エネルギー その結果、運動エネルギーが増加します。 より大きく 運動エネルギー、原子はより激しく振動し、結合を切断します。 したがって、すべての結合の切断は吸熱プロセスです。
そうでなければ、化学結合を形成するために、原子は運動の自由を失い、運動の程度を減らし、運動エネルギーを減らす必要があります。 その後、余剰エネルギーは熱の形で放出されます。 したがって、 すべての結合形成は発熱過程です.
以下の表は、各化学結合に関連するエネルギーの値を示しています。
繋がり |
結合エネルギー(kJ / mol) |
C-H |
412,9 |
C-C |
347,8 |
O = O |
497,8 |
F-F |
154,6 |
番号 |
943,8 |
値はモジュラスであるため、値に符号がないことに注意してください。 これは、リンクが切断されているか形成されているかに応じて、信号をユーザーが割り当てる必要があるためです。
燃焼エンタルピー
NS 燃焼エンタルピー を示すのに役立ちます 1モルの物質の燃焼で放出される熱量. すべての燃焼は熱を放出するため、すべての燃焼反応は発熱性であることに注意する必要があります。
CH4 (g)+ 2 O2 (g)→CO2 (g)+ 2 H2ΔH°NS = -889.5 kJ / mol
以下の表は、いくつかの化学物質の燃焼エンタルピー値を示しています。
物質 |
燃焼エンタルピー(ΔH°NS)kJ / molで |
エタノール-C2NS5OH(1) |
-1368 |
ベンゼン-C6NS6 (1) |
-3268 |
オクタン-C8NS18 (1) |
-5471 |
ブドウ糖-C6NS12O6 (NS) |
-2808 |
物理的状態変化のエンタルピー
物理的状態のすべての変化には、熱交換が含まれます。 したがって、 物理的状態の変化のエンタルピー を示すのに役立ちます 物理的状態変化プロセスに関与する熱量.
たとえば、水の気化があります。
NS2O(1)→H2O(g)ΔH= +44 kJ / mol
水の融解では、次のことがあります。
NS2O(s)→H2O(l)ΔH= +7.3 kJ / mol
エンタルピー値は逆プロセスに対して対称ですこれは、たとえば、水の液化のエンタルピー変化が-44 kJ / molであるのに対し、凝固では-7.3 kJ / molに等しいことを意味します。
あまりにも読んでください: エントロピーとは何ですか?
エンタルピーに関する解決済みの演習
質問1 - (UERJ 2018)燃料として使用される炭化水素の汚染能力は、放出されるエネルギーとCOの量の比率によって決定されます2 その完全燃焼で形成されます。 比率が高いほど、汚染能力は低くなります。 以下の表は、4つの炭化水素の標準燃焼エンタルピーを示しています。

表から、汚染能力が最も低い炭化水素は次のとおりです。
オクタン
ヘキサン
ベンゼン
ペンタン
解像度
代替案D
質問は、汚染能力が放出されたエネルギーとCOの量の間の比率(商)として定義されることを示しています2 その完全燃焼で形成されます。 大きいほど 理由、汚染能力が低いほど、つまりCO1モルあたりに放出されるエネルギーが多くなります。2 生成されます。
の完全燃焼反応 炭化水素 引用されているのは:
オクタン: NS8NS18 +25/2 O2 →8CO2 +9時間2理由:5440/8 = 680
ヘキサン: NS6NS14 +19/2 O2 →6CO2 +7時間2理由:4140/6 = 690
ベンゼン: NS6NS6 + 15/2 O2 →6CO2 + 3 H2理由:3270/6 = 545
ペンタン: NS5NS12 + 8 O2 →5CO2 + 6 H2理由:3510/5 = 702
したがって、ペンタンは汚染能力が最も低い炭化水素であると結論付けることができます。
質問2-(Enem 2015) 森林残渣は再生可能なエネルギー源であるため、その利用は日々魅力的になっています。 この図は、木材廃棄物から抽出されたバイオオイルの燃焼を表しています。ここで、ΔH1 このバイオオイル1gの燃焼によるエンタルピーの変動により、二酸化炭素と液体の水が発生し、ΔH2 気体状態の水1gを液体状態に変換する際のエンタルピー変化。

このバイオオイル5gを燃焼させ、COを生成するためのエンタルピー変動(kJ)2 (ガス状)およびH2(ガス状)は次のとおりです。
A)-106
B)-94
C)-82
D)-21.2
E)-16.4
解像度
代替C
示されているグラフから、ΔHが得られます。1 COを生成するバイオオイル燃焼のエンタルピー変動として2 (g)およびH2O(1)およびΔH2 CO以来の水の液状化のエンタルピー変化として2 ガス状のままで、の物理的状態のみ 水 変化(気体から液体へ)。
この演習では、5 gのバイオオイルの燃焼のエンタルピー変化が求められ、COが発生します。2 (ガス状)およびH2O(ガス状)。 この図から、このエンタルピーの変化は次のように定義できます。ΔH=ΔH1 - NS2. したがって、ΔHの値は-16.4 kJ / gに等しくなります。 このバリエーションは、ユニットで確認できるように、バイオオイルの各グラムに対するものです。 5グラムの場合、私たちはする必要があります 割合:
1gのバイオオイル-16.4kJ
5gのバイオオイルx
1. x = 5。 (-16,4)
x = -82 kJ
次に、代替Cをマークできます。
StéfanoAraújoNovais著
化学の先生
