通常、バーベキューをするとき、ほとんどの人は伴奏として冷たいビールを飲むのが好きです。 冷却を速めるために、飲み物の周りの氷の上に塩を置きます。 これにより、氷が溶けて塩水が氷だけだったときよりも低い温度になります。
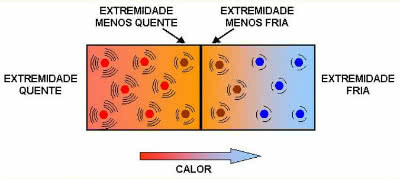
これが起こる理由を正確に理解するために、物質が液体から固体に移行する原因を見てみましょう。 これが起こるためには、分子は運動エネルギーを失う必要があります。 このリリースに影響を与えるいくつかの要因があります。 これらの中には、各物質の分子間力のタイプがあります。 分子の引力が小さいか弱いほど、凝固点は低くなります。
したがって、水の凝固点(凝固温度)は海面で0°Cですが、不揮発性の化合物(塩など)を加えると、 この分子は水分子を強く引き付け、氷の結晶が組織化するのを困難にし、その結果、それらのポイントを下げます 凍結。 比較のために、 10% 塩の場合、凝固点はに下がります -6°C と 20%、 にとって -16°C.
今やめないで... 広告の後にもっとあります;)
したがって、溶媒への非揮発性溶質の添加が生じることが実験的に証明されている。 凝固点が純粋な溶媒よりも低い溶液。 これはの研究の対象です 凝固点降下 また クライオメトリー。
これと同じ原理が、雪が多い地域でも使用されています。 道路の氷を溶かすために、担当部署が路上に塩をまき散らします。 また、車のラジエーター内の水が凍結するのを防ぐために、不凍液として機能する添加剤が追加されています。 最も一般的なのはエチレングリコール(C6NS6O2).
これは、塩(塩化ナトリウム)などのいくつかの非揮発性溶質を含む海水が、これらの領域の温度が0°C未満であるにもかかわらず、液体のままである理由でもあります。

雪が多い国では、道路に塩が投げられます
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
学校や学業でこのテキストを参照しますか? 見て:
FOGAÇA、ジェニファー・ロシャ・バルガス。 「なぜ缶ビールを早く冷やすために塩を氷に入れるのですか?」; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/por-que-se-coloca-sal-no-gelo-para-esfriar-mais-rapido-.htm. 2021年7月27日にアクセス。