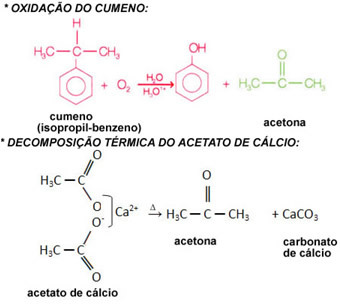
分子は、共有結合によって結合された、同じまたは異なる原子のセットです。
これらの化学種は電気的に中性であり、物質の形成単位を表しています。
酸素(O2)私たちが呼吸する空気の。 ただし、次のような複雑な化合物もあります バッキーボール (球形に結合した60個の炭素原子)、これは宇宙でこれまでに見つかった最大の分子です。
分子研究
分子内の共有結合は、通常は非金属元素間で電子を共有することに対応します。
単純な化合物の例として水分子を参照してください。

ガラスを観察すると 水 この物質がいくつかのH分子で構成されていることはわかりません2O。 この式は、水が3つの原子で構成されていることを示しています。2つの水素原子と1つの酸素原子は、互いに電子を共有しています。
ジュースを甘くしたり、ケーキを作ったりする砂糖も分子でできています。 砂糖の形成単位はショ糖です。

この分子は45個あるのではるかに複雑です 原子 接続されています。 それは12個の炭素原子、22個の水素原子および11個の酸素原子によって形成されます。
分子は既知の分子量の構造ですが、高分子もあります。高分子は、その組成が定義されていないほど多くの原子によって形成される「巨大な構造」です。 このタイプの例は、ダイヤモンドです。これは、 炭素 共有ネットワークで。
共有結合
2つの原子が共有すると、2つの原子間に共有化学結合が確立されます。 電子 より外部的な(原子価の)。 分子には2種類の結合があります。
分子共有結合:2つの結合原子の電子対が共有されます。

共有共有結合(与格):共有電子は、関与する原子の1つだけから来ます。

分子幾何学
分子が形成されると、原子はさまざまな方法で配置されるため、空間配置がより安定します。 したがって、複合材料の形状は異なります。
分子が持つことができる形状のいくつかを次に示します。
| 分子幾何学 | ||
|---|---|---|
| 線形 | Angular | 三角 |
 |
 |
 |
| ピラミッド | 四面体 | 八面体 |
 |
 |
 |
極性および非極性分子
分子は次のように分類されます 極性.
非極性分子:原子間の電気陰性度に違いはありません。
| 窒素(N2) | 二酸化炭素(CO2) |
|---|---|
 |
 |
窒素(N2)それによって形成されるため、非極性分子です 化学元素 したがって、電気陰性度に違いはありません。 二酸化炭素(CO2)は、電子による酸素の引力を安定させる直線形状のため、無極性です。
極性分子:原子間で電気陰性度に差があり、正極と負極があります。
| 水(H2O) | アンモニア(NH3) |
|---|---|
 |
 |
どちらの例でも、中心原子である酸素と窒素には、電子雲を形成する不対電子対があることがわかります。 確立された化学結合よりも中心原子の周りに多くの電子雲があるため、分子は極性があります。
分子の例
| 物質 | 特徴 | 分子 | 式 |
|---|---|---|---|
| 水素 | 燃料と地球の地殻に豊富にあります。 |  |
H2 |
| 酸素 | 呼吸に不可欠で、さまざまな化学反応に参加します |  |
O2 |
| 硫黄 | 染料を作るために使用される黄色い粉末。 |  |
s8 |
| 二酸化炭素 | 消火器や冷媒に使用されます。 |  |
CO2 |
| エタノール | 燃料や香水に使用される一般的なアルコール。 |  |
Ç2H6O |
あなたが今学んだことに関連するトピックに関するこれらのテキストを必ずチェックしてください:
- 生体分子
- 有機化合物
- 分子量
- オクテット則
- 化学結合
- 接続極性
- 分子間力