一酸化炭素は、無色、無臭、可燃性、有毒なガスです。
その分子式は CO. 炭素と酸素の分子で構成されています。
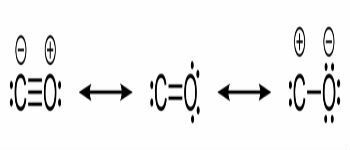
一酸化炭素の構造式と炭素と酸素の間の化学結合
それは2つの方法で始まります:
- 自然放送ソース:火山、天然ガス、放電の活動。
- 人間の活動: の結果 燃焼 不完全な化石燃料。 燃焼は大量のCOを生成し、COを大気中に放出する主要な活動の1つです。
特徴
一酸化炭素はのグループに属しています 酸化物. それはとして分類されます 中性酸化物、金属と酸素によって形成されたもの。 さらに、それは水、酸および塩基と反応しません。
それは還元剤として使用され、化合物から酸素を除去し、 二酸化炭素 (CO2). したがって、鉄などの鉱石の処理での使用は非常に一般的です。 酢酸、プラスチック、メタノールなどの有機物質の製造にも使用されます。
空気中の酸素と反応すると、二酸化炭素が発生します。 次の化学反応によると: 2 CO + O2 →2CO2
地表水では、高濃度の一酸化炭素が微生物のエネルギー源として機能します。
一酸化炭素はのガスの1つです 温室効果. 大気中のその濃度は、より大きな保温に貢献します。 したがって、それは汚染ガスと見なされます。
酩酊
COはヘモグロビンに対して高い親和性を持っています。 それは有毒であるため、その吸入は人間の健康に影響を及ぼし、死に至ることさえあります。
COは臭いがないため、気づかれずに吸入されている可能性があります。 そのため、酩酊に気付くまでに時間がかかる場合があります。
低濃度で吸入すると、片頭痛、思考の遅さ、目の炎症、手作業能力の喪失を引き起こします。 高濃度では、発作、意識喪失、さらには窒息死を引き起こす可能性があります。
しかし、中毒はどのように起こりますか?
THE ヘモグロビン もちろん、Oに接続します2 そしてそれを体組織に輸送します。 ただし、COとヘモグロビンの親和性ははるかに大きく、Oの場合の約250倍です。2.
COの存在下では、ヘモグロビンがそれに結合し、細胞への酸素の輸送を防ぎます。 COとヘモグロビンの組み合わせは、カルボキシヘモグロビンを生じさせます。
CO中毒の主な原因は、次の状況で発生します。
- 屋内で動作する車のエンジン。
- のやけど 天然ガス 非効率的なヒーターで;
- 換気の悪い場所でのキッチンまたは薪オーブンからのガス排気。
寒い気候の国では、家はより長く閉鎖されたままで、暖房システムを使用する傾向があります。 ガス事故を回避するために、CO検出器がますます使用されています。
詳細については、以下もお読みください。
- 炭素循環
- 炭素
- 化石燃料
- 酸素



