電気化学は、電子の移動と化学エネルギーの電気エネルギーへの相互変換を伴う反応を研究する化学の分野です。
電気化学は、電池、携帯電話、懐中電灯、コンピューター、電卓など、私たちの日常生活で使用される多くのデバイスの製造に適用されます。
酸化反応
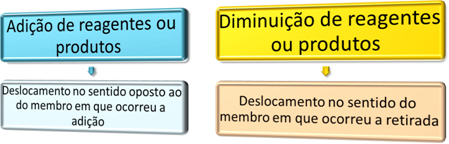
電気化学では、研究された反応は レドックス. それらはの損失と増加によって特徴付けられます 電子. この意味は 電子移動 ある種から別の種へ。
その名前が示すように、レドックス反応は2つのステップで発生します。
- 酸化:電子の喪失。 酸化を引き起こす元素は酸化剤と呼ばれます。
- 削減:電子ゲイン。 還元を引き起こす要素は還元剤と呼ばれます。
ただし、誰が電子を獲得し、誰が電子を失うかを知るには、元素の酸化数を知る必要があります。 このレドックスの例を参照してください。
Zn(s)+ 2H+(aq)→Zn2+(aq)+ H2(g)
亜鉛元素(Zn2+)は2つの電子を失うことによって酸化されます。 同時に、それは水素イオンの還元を引き起こしました。 したがって、それは還元剤です。
(H)イオン+)電子を獲得し、還元を受けます。 その結果、亜鉛の酸化を引き起こしました。 酸化剤です。
についてもっと知る 酸化.
電池と電気分解
電気化学の研究には、電池と電気分解が含まれます。 2つのプロセスの違いは、エネルギー変換です。
- THE セルは化学エネルギーを電気エネルギーに変換します、自発的に。
- THE 電気分解は電気エネルギーを化学エネルギーに変換します、自発的にではありません。
についてもっと知る エネルギー.
スタック
電気化学セルとも呼ばれるセルは、酸化還元反応が起こるシステムです。 それは2つの電極と電解質で構成されており、これらが一緒に生成されます 電気. 2つ以上のバッテリーを接続すると、バッテリーが形成されます。
電極は、電子の交換を可能にする固体の導電性表面です。
- 酸化が発生する電極はアノードと呼ばれ、バッテリーの負極を表します。
- 還元が行われる電極は、バッテリーの正極であるカソードです。
電子はアノードで放出され、カソードへの導線をたどり、そこで還元が起こります。 したがって、電子の流れはアノードからカソードに流れます。
電解質または塩橋は、電子を伝導する電解質溶液であり、システム内での電子の循環を可能にします。
1836年、ジョンフレドリックダニエルは次のように知られるようになったシステムを構築しました ダニエルパイル。 彼は金属線で2つの電極を相互接続しました。
1つの電極は、硫酸亜鉛(ZnSO)の水溶液に浸された金属亜鉛板で構成されていました。4)、アノードを表します。
もう一方の電極は、硫酸銅(CuSO)の溶液に浸された金属銅板(Cu)で構成されていました。4)、カソードを表します。
カソードで銅の還元が起こります。 一方、アノードでは亜鉛の酸化が起こります。 次の化学反応によると:
陰極:お尻2+(aq)+ 2e- | →Cu0(s)|
アノード:Zn0(s)| →Zn2(aq)+ 2e-|
一般的な方程式:Zn0(s)+ Cu2+(aq)| →Cu0(s)+ Zn2+(aq)|
「|」 反応物と生成物の間の位相差を表します。
電解
THE 電解 これは、外部ソースからの電流の通過によって引き起こされる、非自発的な方法で発生する酸化還元反応です。
電気分解は火成岩または水性である可能性があります。
火成電気分解は、溶融電解質から、つまり融合プロセスによって処理されるものです。
水性電解では、使用されるイオン化溶媒は水です。 水溶液中では、電気分解は不活性電極または活性(または反応性)電極を使用して実行できます。
アプリケーション
電気化学は私たちの日常生活に非常に存在しています。 いくつかの例は次のとおりです。
- 人体の反応;
- さまざまな電子機器の製造。
- バッテリーの充電;
- 電気めっき:金属亜鉛による鉄および鋼部品のコーティング。
- 化学産業におけるさまざまなタイプのアプリケーション。
金属錆は、金属鉄(Fe)が鉄カチオン(Fe)に酸化することによって形成されます。2+)空気と水の存在下にあるとき。 さびは一種のさびと見なすことができます 電気化学的腐食. 電気めっきプロセスによる金属亜鉛のコーティングは、鉄が空気と接触するのを防ぎます。
演習
1. (FUVEST)-IおよびIIは、標準状態で、示された意味で、水中で自発的に発生する反応の方程式です。
私。 Fe + Pb2+ →Fe+2 + Pb
II。 Zn + Fe2+ →Zn2+ + Fe
このような反応を単独で、または一緒に分析すると、標準的な条件下では、
a)電子はPbから移動します2+ 鉄のために。
b)自発反応はPbとZnの間で発生する必要があります2+.
c)Zn2+ Feよりも優れた酸化剤でなければなりません2+ .
d)Znは自発的にPbを還元する必要があります2+ Pbに。
e)Zn2+ 鉛よりも優れた酸化剤でなければなりません2+.
d)Znは自発的にPbを還元する必要があります2+ Pbに。
2. (Unip)鉄または鋼の物体は、いくつかの方法で腐食から保護できます。
I)保護層で表面を覆う。
II)対象物を亜鉛などのより活性の高い金属と接触させる。
III)銅などの活性の低い金属と物体を接触させる。
正しいです:
a)私だけ。
b)IIのみ。
c)IIIのみ。
d)IとIIのみ。
e)IとIIIのみ
d)IとIIのみ。
3. (Fuvest)スーパーマーケットで一般的に見られるタイプの山では、負極は亜鉛の外側コーティングで構成されています。 亜鉛が負極として機能することを可能にする半反応は次のとおりです。
a)Zn+ +および- →Zn
b)Zn2+ + 2e- →Zn
c)Zn→Zn+ +および-
d)Zn→Zn2+ + 2e
e)Zn2+ + Zn→2Zn+
d)Zn→Zn2+ + 2e