O ルシャトリエの原理 平衡状態にあるシステムに外乱が発生すると、その外乱によって生成される力を最小化し、新しい化学平衡を回復する方向にシフトすることを示しています。
これらの障害の1つは 温度変化. この変動は、平衡シフトを引き起こすだけでなく、平衡定数Kの値も変化させるため重要です。ç.
これがどのように発生するかをよりよく理解するために、例を見てみましょう。
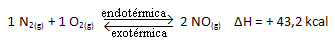
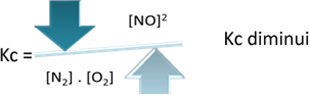
Kç = _ [で]2___
[N2]. [O2]
上記の反応は、エネルギー吸収を伴う直接方向で発生し、吸熱反応です。 一方、逆のプロセスは、発熱反応であるエネルギーの放出で発生します。
したがって、システムの温度を上げると、化学平衡は吸熱反応に向かってシフトします。この反応では、この反応は右側にあります。 これは、熱が吸収され、平衡が回復するためです。
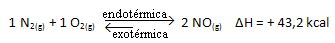
逆もまた真です。 このシステムの温度を下げると、反応の総エネルギーが減少するため、反応は熱を放出する方向にシフトします。 これは、バランスが発熱反応に向かってシフトすることを意味します。この場合は、左側にあります。
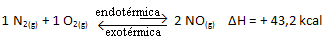
要するに:

平衡定数(Kç)、温度が上昇すると、それは吸熱反応を促進し、より多くのNO(g) が形成され、その濃度が増加し、反応物の濃度が減少します。 以下の式で、NOの濃度が(g) 定数Kに正比例しますçしたがって、次のようにも増加します。
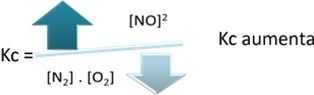
しかし、温度を下げて反応を発熱反応にシフトすると、NO生成物の濃度が低下し、反応物の濃度が上昇します。 反応物の濃度は定数Kcに反比例するため、次のように減少します。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm

