質量数 (大文字のAで表されます)は、数量を決定するために使用される金種です。 陽子 そして 中性子 任意の原子の核内に存在します(略語Xで表されます)。
私たちが代表するとき 質量数 以下の一般的なパターンでわかるように、任意のアトムの正しい書き方は、アトムの略語の右上または左側にあります。

質量数表現モデル
原子内の陽子の数は、 原子番号 (Z)は、常に原子の略語の左側、下部に配置されます。
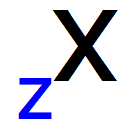
任意の原子のイニシャルでの原子番号の表現
として 質量数 常に原子核内の陽子(p)と中性子(n)の量を示し、次の定義に基づいて式が作成されました。
A = p + n
この数式から、次のことを決定する条件があります。
質量数: 陽子の数と中性子の数に基づいています。
陽子の数:質量数と中性子数に基づいて、方程式を次のように書き直します。
p = A-n
中性子の数:質量数と陽子数に基づいて、方程式を次のように書き直します。
n = A-p
最初の例: 塩素原子の核に存在する中性子の数を決定し、 17Cl35.
ステートメントでは、頭字語に2つの値があります。1つは原子番号または陽子の数である左下にあり、もう1つは質量数です。
Zまたはp = 17
A = 35
中性子の数を決定するには、原子量の計算に使用される式で提供されている値を使用して、次のように書き直します:
n = A-p
n = 35-17
n = 18
2番目の例: スカンジウム原子の質量数と中性子数がそれぞれ43と21であるとすると、スカンジウム原子の核内に存在するプロトンの数はいくつですか?
この演習では、質量数と中性子数の2つの値が提供されます。 すぐに:
A = 43
n = 21
陽子の数を決定するには、原子量の計算に使用される式で提供されている値を使用して、次のように書き直します:
p = A-n
p = 43-21
p = 22
3番目の例: 原子番号が60で、原子核内に88個の中性子がある原子の質量数はいくつですか。
この演習では、原子番号(または陽子の数)と中性子の数の2つの値が与えられます。 すぐに:
Zまたはp = 60
n = 88
中性子の数を決定するには、計算に使用される式で提供される値を使用するだけです 質量数:
A = p + n
A = 60 + 88
A = 148
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-massa.htm

