炭素は、原子番号(Z)が6に等しい化学元素です。これは、炭素を形成する原子の核に6つの陽子があることを意味します。 そのモル質量は12,011g / molであり、炭素の3つの同位体が自然界に見られます。 カーボン-12, 炭素13 そして 炭素14. C-12は、核内に6つの陽子と6つの中性子を持ち、最も豊富です。
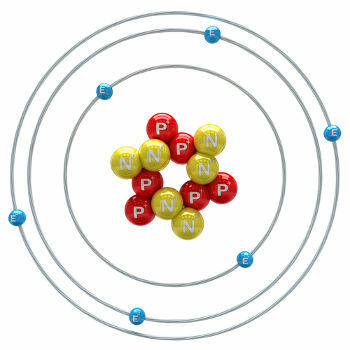
炭素12原子の図
C-13には7つの中性子があり、最も豊富ではありません(1.01〜1.14%)。 C-14には8つの中性子があり、 放射性元素 これはβ粒子(電子)を放出し、宇宙線中性子が大気の上層に存在する窒素14に衝突すると、地球の成層圏で形成されます。 それはすべての動植物に組み込まれ、その半減期が約5730年であることを知って、10万年から4万年の間の化石の年齢を決定するために使用されます。 C-14と年代測定法の詳細については、本文をご覧ください。 炭素14とは何ですか?
炭素は4価です。つまり、オクテット則に従うには、原子価層(最外層)にさらに4つの陽子が必要です。 したがって、通常は4つの共有結合を形成し、他の元素や他の炭素と4対の電子を共有します。 これらの結合は、単一、二重、または三重であり、何百万もの異なる化合物の形成をもたらします。 このため、化学の領域が作成されました、 有機化学、炭素に由来する主な化合物を研究します。ただし、次のような鉱物由来の場合を除きます。 二酸化炭素(CO2)、O 一酸化炭素(CO)、O 炭酸カルシウム(CaCO3)、重曹または 重曹(NaHCO3)、他の人の間。 これらの化合物はで研究されています 無機化学.
炭素は同素体を形成し、単純な物質、つまり炭素原子間の結合によってのみ形成される物質を形成します。 炭素には少なくとも7つの同素体があり、グラファイト(アルファおよびベータ)、ダイヤモンド、ロンズデーライト(六方晶ダイヤモンド)、チャオ石、炭素(VI)、およびフラーレンです。 実際には、合成同素体の炭素であるフラーレンにはいくつかの種類があります。 それらは各頂点に炭素原子を持つ多面体構造を持っており、例は Ç60 と呼ばれる バックミンスターフラーレン、そしてその構造はサッカーボールのように見えます。
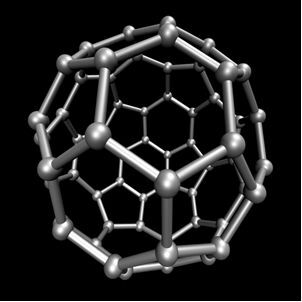
カーボン-60(バックミンスターフラーレン)
しかし、これらの炭素の同素体の中で、自然なものは2つだけです。
黒鉛それはからです ダイヤモンド. 下の図に示すように、それらは空間内の原子の結晶配列のみが異なり、その結果、物理化学的特性がまったく異なります。 テキストを読む 炭素同素体 詳細については。
炭素の2つの自然な同素体は、グラファイトとダイヤモンドです。
炭素の別の合成同素体は ナノチューブ (下の画像)医療診断や治療など、幅広い生物学的用途があります。

微視的なカーボンナノチューブのイラスト
したがって、 炭素は私たちの周りや私たちの中に存在します、彼が作曲しているので 天然有機化合物— 石油、石炭、天然ガスなどの化石燃料や、エタノールやバイオ燃料などのその他の燃料、とりわけ農産物など。 形も 合成有機化合物、布地を構成する合成繊維、医薬品、プラスチックやゴムを構成するポリマー、殺虫剤、染料など。 私たち、動物や野菜の中で、炭素は、砂糖、ブドウ糖、セルロースなどの炭水化物などの非常に重要な化合物を形成します。 たとえば、DNAを形成し、脂質と一緒になって赤血球と白血球の膜を形成するタンパク質。
これらすべてが、生命を維持するための炭素の重要性を示しています。 しかし、それはまた、 温室効果 そしてその結果 地球温暖化、これは、これらの問題の主な悪役が二酸化炭素化合物(CO2). 主にこのガスを放出する化石燃料の大量燃焼により、COの濃度2 大気中が増加しています。 温室効果ガスとして、それは言及された問題を引き起こします。 一方、二酸化炭素は光合成や呼吸などの重要な反応にも存在します。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-carbono.htm

