残高熱の 体が自分自身を見つける状態です 同じ温度 周囲よりも。 隣接する物体よりも高温になっているすべての物体は、両方が同じ温度を示し始めるまで、自発的に熱を与える傾向があることが観察されています。
見てまた:サーモロジーの基礎
熱平衡と熱力学のゼロ法則
熱平衡は、熱力学のゼロ法則の背後にある中心的な概念です。 そのような法則は、2つの熱力学系が THE そして B、は3番目の熱力学系と熱平衡にあります。 Ç、その後、 THE そして B それらはまた熱平衡になります。
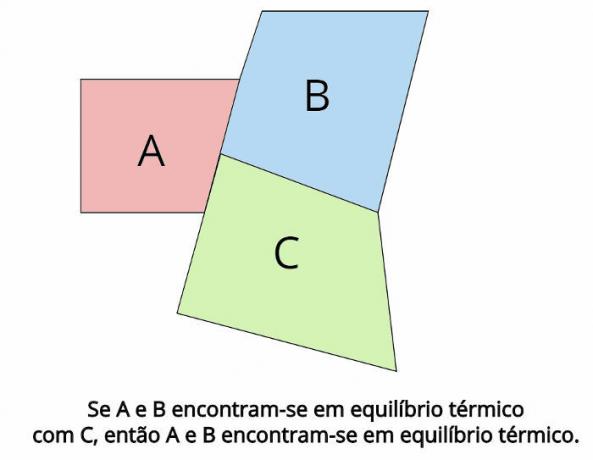
熱平衡では、各物体の最終温度は等しくなければなりません:TTHE = TB = TÇ
熱力学のゼロ法則のステートメントが確立するものを確認してください。
“2つの物体が3番目の物体と熱平衡にある場合、それらの物体は互いに熱平衡になります。」
熱バランスを理解する別の方法は、体の内部エネルギーに基づいています。 内部エネルギー、または単に熱エネルギーは、物理量です 直接比例 à 温度 体の。 したがって、同じ熱力学系内に異なる温度の物体がある場合、それらは異なるモジュールを持ちます。 内部エネルギー、したがって、それらのエネルギーの間に違いがなくなるまで、それらの間でそのエネルギーの一部を転送します。 内部。 内部エネルギーとは何か、そしてその特性とは何かについてもっと知りたいですか? 記事にアクセスします。 内部エネルギー。
今やめないで... 広告の後にもっとあります;)
熱と熱のバランス
熱伝達は、最高温度の体から最低温度の体へと常に自発的に発生します。 熱の形でのこのエネルギーの伝達は、次のようなプロセスを通じて発生する可能性があります。 運転, 対流 そして 放射線。
運転: 特に固体で発生するのは、物体間の熱伝達です。 このタイプの伝導では、質量移動は発生しません。 このタイプの熱伝達は、たとえば金属で熱平衡がどのように発生するかを説明します。
対流: これは、流体内で発生する熱伝達です。 この熱伝達モードでは、加熱された流体が移動するときに物質移動が発生し、すべての流体が熱平衡に達するまで対流が形成されます。
放射線: これは電磁波を介した熱の伝達であるため、このプロセスは、体と別の体との間に異なる温度の物理的媒体がない場合でも発生します。 この場合、伝達される熱は、より少ないエネルギーの電磁波と同等です。 熱放射の場合、の領域にある可視光 赤外線。
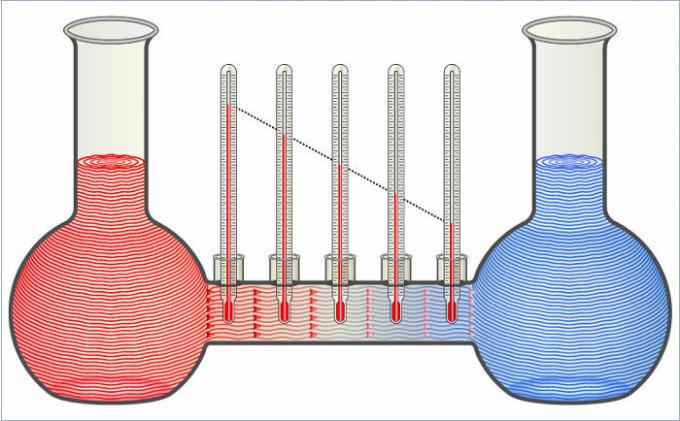
図の2つの液体は、温度が等しくなるまで互いに熱を伝達します。
各熱伝達プロセスがどのように行われるかについてもっと知りたいですか? 記事にアクセスします。 熱伝播プロセス.
顕熱
あるとき 差に温度 2つの物体間、または物体とその周囲の間では、それらの間で自発的に熱交換が行われるため、 高温の物体は冷却され、低温の物体はすべてが温度に達するまで加熱されます に 残高熱の。
異なる温度で物体間で交換される熱量は、 顕熱 この金額は、次の図に示す式から計算できます。
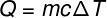
Q –熱(ライムまたはJ)
m –質量(gまたはkg)
ç -比熱(cal /gºCまたはJ / kg。 K)
ΔT –温度変化(°CまたはK)
上記の式では、名前の素晴らしさを強調することが重要です 比熱. そのような大きさは 物質の温度を1°C変化させるために、物質が生成または吸収する必要のある質量あたりのエネルギー量。 たとえば、純水の場合、通常の圧力条件下で、その温度を1ºC変化させるには、水1グラムあたり1.0カロリーが必要です。
したがって、互いに熱接触を確立したすべての物質は、次の状態に達する傾向があります。 残高熱の しかし、時間の経過とともに自発的にそうするためにより多くのエネルギーを必要とするものもあり、これは熱平衡に達するために温度に直接影響します。
読んだまた:温度とは何ですか?
潜熱
周囲との熱交換中に、身体が圧力、温度、および体積を示し、それによって身体の状態が変化する可能性があります。 これらの変更はで発生します 温度絶え間ない (不純物を含まない単一の物質で構成される物体の場合)、つまり、外部環境に熱を受け取ったり与えたりしても、これらの物体の温度は変化しません。
これが可能なのは、交換されたすべてのエネルギーが、この場合、分子のコンフォメーションを変更するために使用されているためです。 エネルギー障壁が「克服」され、すべての体の内容が別の物理的状態にある瞬間から、 もちろん、その温度が外の温度と等しくない限り、体は周囲と熱を交換し続けます。
O 潜熱 次の図に示す式から計算できます。確認してください。
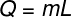
Q –潜熱(ライムまたはJ)
m –質量(gまたはkg)
L –特定の潜熱(cal / gまたはJ / kg)
熱平衡式
何であるかを知りたい場合 温度に残高 一部の熱力学系では、問題の系を次のように考える必要があります。 システム孤立つまり、このシステムの近傍と熱が交換されないと想定する必要があります。
この状態から、交換される熱の全量は、このシステムを構成する物体間でのみ交換されると言えます。 熱損失を無視する たとえば、コンテナの壁に。 この場合、コンテナには 熱容量 無視できる、すなわちそれは熱を吸収しません。
次の状況を想像してみてください。熱容量がごくわずかな熱いお茶に、角氷を注ぎます。 熱平衡温度を決定するには、システムの初期条件を知ることに加えて、いくつかの考慮事項を考慮する必要があります。
カップの熱容量はごくわずかであるため、熱いお茶が氷に与えるすべての熱量は、氷によって完全に吸収されます。
このお茶を閉じた熱力学的システムとして理解できるように、空気やその他の周囲への熱損失を無視する必要があります。
このようにして、氷が受けた熱の全量が熱いお茶によって放棄されたことを確認できます。それで、熱バランスを計算するための式を作成しました。
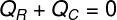
QR –受けた熱
QÇ –与えられた熱
(Qで与えられる熱Ç)、挿入された角氷に熱いお茶が移った熱量を指します。 すでに受けた熱(QR)は、これらの角氷が受けた熱量です。 この熱量には2つの性質があります:熱 敏感 と暑い 潜在的なぜなら、熱平衡に入るには、角氷が溶ける可能性が高いからです。
熱平衡温度の決定
次の状況から熱平衡温度を決定しましょう。
70°Cの初期温度で200ml(200g)のお茶が入っている、熱容量が無視できるカップには、-10°Cの温度で10gの氷が入ります。 システムの熱平衡温度を決定します(お茶の比熱が水の比熱に等しいと仮定します)。
データ:
ç水 = 1.0cal / g°C
ç氷 = 0.5cal / g°C
L氷 = 80カロリー/ g
まず、氷が受けた熱はすべてお茶によって放出されたと考えます。

次に、どの形式の熱が与えられ、受け取られたかを詳しく説明する必要があります。
お茶: お茶は顕熱しか与えませんでした(Qs)、彼の体調は変わっていないので。
氷:氷は当初-10°Cであったため、顕熱を受けました(Qs)温度が0ºCになるまで、潜熱(QL)液化する。 液体になった後、潜熱を受けました(Qs)熱平衡に入るまで(TF)お茶と。
上で分析したものを方程式の形に変換すると、次の計算で解くことができます。
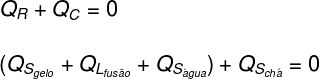
上記の方程式の演習で提供されたデータを置き換えることにより、次の計算を解く必要があります。
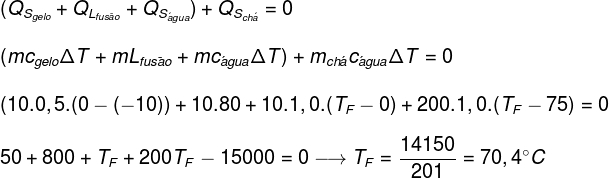
上記の計算によると、お茶と氷のシステムの平衡温度は約70.4°Cである必要があります。
熱平衡実験
2つの物体間の熱バランスをテストするために、いくつかの実験を実行できます。 ただし、これらの中で最も単純なものは、 熱量計 それは 温度計. 熱量計は、熱容量を備えた断熱容器(熱の通過を許可しない)です。 約無視できる、たとえば発泡スチロールで裏打ちされた鍋のように、これは優れた断熱材です。

熱量計は、内部のシステムの温度変化を測定するために使用されます。
地球上の熱収支と生命
O 残高熱の それは陸生生物において基本的な役割を果たしています。 地球の大気中に温室効果ガスが存在しない場合、 熱放射 惑星のはそれを去り、宇宙に伝播するでしょう。 時間が経つにつれて、これは地球全体に大規模な冷却を引き起こし、海を時間の経過とともに凍結させます。
さらに、海は 残高熱の 惑星の。 その偉大さのおかげで パスタ そして 熱明確な、 海は巨大なものに恵まれています 容量熱の、 つまり、温度を変えるために大量の熱を受け取る必要があります。 このため、彼らは惑星の温度を非常に効率的に調整することができます。 海から遠く、水がほとんどない地域は、通常、大きく存在します 熱範囲、日中は非常に暑く、夜は凍る砂漠の場合のように。
したがって、 残高熱の それは、惑星の物理的、化学的、生物学的プロセスを維持するために基本的に重要なプロセスであり、したがって、地球上の生命の存在に不可欠です。
私によって。ラファエル・ヘラーブロック



