THE 電気陰性度 これは、原子が別の化学元素に結合しているときに、原子がそれ自体に向かって電子を引き付ける傾向です。 共有結合を介して、つまり、この分子を次のように見なして、電子を共有します。 隔離された。
提示された概念をよりよく理解するために、2つの例を考えてみましょう。
1番目の例:水素ガス分子:H2 →H-H
2つの水素原子が一緒になると、それぞれの原子核間の引力が同時に発生します。 これらの原子の1つは、他の原子の電子と、電子と2つの原子核の間の反発力によるものです。 原子。 これらの力が平衡に達すると、2つの電子は2つの間のどこかにあるエレクトロスフィアの領域にあります。 両方が2つの電子と相互作用して安定する、つまり2つの原子が1対の分子を共有する分子の原子 電子。
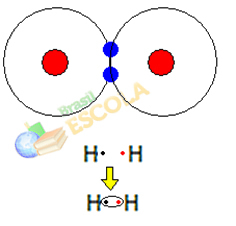
これは共有結合であり、分子を形成します。 しかし、この分子の2つの原子はまったく同じであるため、それらが互いに電子を引き付ける方法も同じです。 だから私たちはそれを言います 電気陰性度の違いはありません または彼女は それは無極性です.
2番目の例:塩化水素分子:HCℓ
この場合、電子対の共有は、異なる要素間で実行されます。これに関連して、 塩素原子は水素よりも強い強度で電子を引き付けます。 したがって、塩素は水素よりも電気陰性度が高いと言えます。
下の図に示すように、電気陰性度の違いにより、 電気双極子(μ)、 これは2つの電気単極子であり、電子は塩素に引き付けられる傾向があります。 したがって、結合H─Cℓは塩素に対して部分的に負の電荷を持ちます(δ-)および水素の部分的な正電荷(δ+). だからこれは分子です 電気陰性度の違いあり そして 極地:
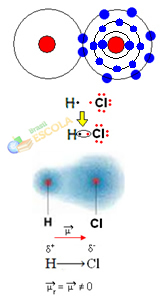
これは、電気陰性度が絶対量ではなく相対量であることを示しています。これは、共有結合内の原子によって加えられる力の比較を考慮して決定されるためです。
電気陰性度を計算する方法はいくつかありますが、最も一般的な方法は Paulingによって提案された電気陰性度スケール。 ジェネリック分子があるとしましょう A─B。 Paulingは、Dで表されるこの分子の結合エネルギーは、結合エネルギーの算術平均の合計によって与えられると提案しました。 (D)これら2つの原子、つまりA-AとB-Bのガス分子の、その分子の各原子の電気陰性度の差の2乗 (バツTHE およびxB):
今やめないで... 広告の後にもっとあります;)
D(A-B) = [D(A-A) + D(B-B)] + k(xTHE - バツB)2
上記の式の定数kは96.5kJに等しくなります。 モル-1. ポーリングは、水素の電気陰性度に任意の値を割り当てました。これは2.1であり、 このようにして、他の元素の電気陰性度の値を以下に関連して発見することができました。 彼。
この方法に基づいて、希ガスを除いて、周期表の元素のポーリング電気陰性度の値が与えられました。

これらの値は、元素の原子番号に基づいて周期的に変化するため、周期的なプロパティであることに注意してください。 たとえば、最も電気陰性度の高い元素は、表の右上隅にある元素、つまりフッ素であることがわかります。 (4.0)と酸素(3.5)、そして最も電気陰性度が低いのは左下隅にあるもので、フランシウム(0.8)とセシウムです。 (0,8).
これに基づいて、最も作用する傾向のある最も電気陰性度の高い元素の電気陰性度の列が作成されました。
F> O> N>Cℓ> Br> I> S> C> P> H
電気陰性度の値を参照してください。
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
この電気陰性度の行を飾る一種の「トリック」があります。これは、以下の文で示されます。各単語の頭文字は、問題の要素の記号に対応しています。
“Fこんにちは Oありません NO Cl宇部、 br私は得た 私s痛い Ç死んでいる Pのために H病院"
だから私たちはそれを言うことができます 電気陰性度は、周期表の左から右、下から上に増加する周期特性です。

これは、原子半径のサイズによるものです。 原子の半径が大きいほど、共有電子はその原子核から遠く離れているため、それらの間の引力は弱くなります。 逆もまた真であり、原子半径が小さいほど、電子は原子核に近くなり、それらの間の引力が大きくなります。 したがって、次のように結論付けることができます。
電気陰性度は、原子半径が小さくなると増加します。
ジェニファー・フォガサ
化学を卒業



