溶液は、2つ以上の物質の均一な混合物です。. たとえば、水(溶媒)に溶解した塩(溶質)の溶液として。

特に化学実験室や産業では、化学者が既知の濃度の溶液を準備する必要があるため、このプロセスは非常に重要です。 さらに、実験活動では、非常に低濃度の溶液が使用されるため、濃縮溶液のサンプルは目的の濃度に希釈されます。
毎日数回、気づかないうちに溶液を希釈する工程を行っています。 たとえば、消毒剤などのクリーニングおよび家庭用衛生製品のパッケージでは、使用前に希釈することをお勧めします。 一部のメーカーは、製品ラベルで1〜3の割合で水で希釈することを提案しています。つまり、製品の各部分に3部の水を追加する必要があります。 これは、製品が非常に濃縮されており、適切な方法で希釈されていない場合、適用される場所に損傷を与える可能性があるためです。 一方、必要以上に希釈すると、製品が目的の結果を達成できないため、お金を失う可能性があります。

もう1つの例は、ジュースを作るときです。 多くの濃縮ジュースのラベルには、1杯のジュースを5杯の水で希釈または混合する必要があることが示されています。 したがって、ジュースは「弱く」なります。つまり、濃縮度が低くなります。
今やめないで... 広告の後にもっとあります;)
このようなジュースを3Lの水で希釈したと想像してみてください。 初期ジュース濃度が40g / Lの場合、溶媒1リットルあたりの質量が40gであることを意味します。 しかし、3 Lになるので、質量を3で割ると、濃度は約13、33 g / L、つまり溶液1リットルあたり13グラムになります。 ただし、ソリューション全体で、40gの溶質の質量はまだ残っています。
この新しい濃度の計算は、次のように実行できます。
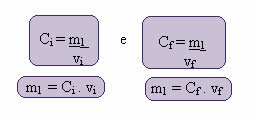
ここで、インデックスiとfは、それぞれ初期値と最終値を表します。 m1の値は変更されていないため、次の式を等式化できます。
Ç私. v私 = Cf. vf
前の例によると、私たちが持っている値を置き換えることに注意してください:
初期の解決策:
Ç私:40g / L
m1:40g
v私:1L
最終的解決:
Çf: ?
m1:40g
vf:3L
Ç私. v私 = Cf. vf
(40g / L)。 (1 L)= Cf. 3L
Çf = 40 g / L
3
Çf = 13.333 g / L
同じ理由が、モル濃度(M)および溶質または力価の質量パーセント(T)にも当てはまります。
M私. v私 = Mf. vf そして T私. v私 = Tf. vf
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "溶液の希釈"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. 2021年6月27日にアクセス。