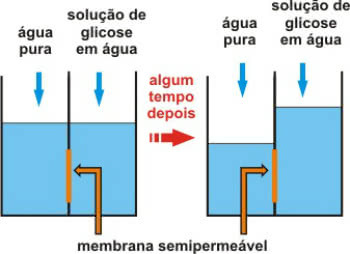
テキスト 滴定 この容量分析技術がどのように実行されるかを示しました。その主な目的は 既知の濃度の別の溶液との反応を通じて、溶液の濃度を特定します.
ここで、滴定で得られたデータを使用して、溶液中の酸または塩基である目的の濃度に到達する方法を説明します。 そのためには、基本的に3つのステップがあります。
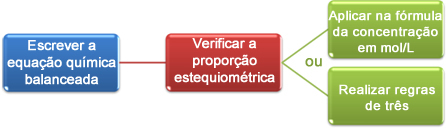
例を見てみましょう:
化学者が酢酸(酢(CH))の溶液を持っていたとしましょう3COOH(ここに)))そしてmol / Lでその濃度を知りたいと思った。 次に、20.0 mLの酢(滴定)を三角フラスコに入れ、フェノールフタレイン指示薬を加えました。 次に、100 mLのビュレットに1.0mol / Lに等しい既知の濃度(滴定剤)の水酸化ナトリウム(NaOH)を充填しました。 最後に、化学者は滴定を実行し、24 mLのNaOHが消費されたときに色の変化(転換点-滴定を停止したとき)が発生したことに気づきました。

この実験に基づいて、彼は次のデータを取得しました。
MCH3COOH= ?
VCH3COOH = 20 mL = 0.02 L
MNaOH = 24 mL = 0.024 L
VNaOH = 1.0 mol / L
ここで、M = mol / L単位の濃度、V = L単位の体積。
酢酸の濃度を知るには、まず、発生した適切にバランスの取れた中和反応を表す化学式の書き方を知る必要があります。 この場合の反応は次のとおりです。
1 CH3COOH(ここに) + 1 NaOH(ここに) →1NaC2H3O2(aq) +1時間2O(ℓ)
この部分は、反応物が反応する化学量論比を確認するために重要です。 比率は1:1であることに注意してください。つまり、酢酸1モルごとに、1モルの水酸化ナトリウムが必要です。
これで、2つの方法で計算を進めることができます。
(1回目)式による:M1. V1 = M2. V2
化学量論比は1:1であるため、次のことを行う必要があります。 番号CH3COOH = nNaOH .
今やめないで... 広告の後にもっとあります;)
であること M = n / V → n = M。 V. したがって、上記のリストに到達します。この場合、次のように記述できます。 MCH3COOH。 CH3COOH = MNaOH。 VNaOH
したがって、この式の値を置き換えるだけです:
MCH3COOH。
V CH3COOH = MNaOH。 VNaOHMCH3COOH。 0.02 L = 1.0 mol / L. 0.024 L
MCH3COOH = 0.024モル
0.02 L
MCH3COOH = 1.2 mol / L
したがって、私たちのタイトルである酢酸溶液の初期濃度は、 1.2mol / L。
重要な注意点:化学量論比が1:1でない場合は、物質のmol / L(M)単位の濃度にそれぞれの係数を掛けるだけで十分です。 たとえば、比率が1:2の場合、次のようになります。
M1. V1 = 2. M2. V2
ただし、これらの計算を実行する別の方法は次のとおりです。
(2番目)3つのルールを通して:
1 CH3COOH(ここに) + 1 NaOH(ここに) →1CH3COONa(ここに) +1時間2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60g1。 40 g1。 82 g1。 18グラム
これらの質量は、各物質について計算された分子量です。
* 1.0 mol / LのNaOH溶液の使用量が(ここに) 24 mLだったので、最初に反応したNaOHの物質量(mol)を見つけることができます。
1molのNaOH→1.0L
1molのNaOH1000 ml
x 24 ml
x = 0.024molのNaOH
※比率は1:1なので、酢酸の物質量(mol)はNaOHと同じ0.024molにする必要があります。
観察: 化学量論比が異なる場合は、この部分でそれを考慮に入れます。 たとえば、それが1:3で、1つの化学反応種の物質量が0.024 molに等しい場合、他の物質の物質量は3倍の0.072になります。
*ここで計算します:
酢20ml0.024mol酢酸
酢1000mlと
y = 1.2 mol
つまり、1.2 mol / Lであり、これは前の方法で得られた値と同じです。
ジェニファー・フォガサ
化学を卒業