ヘスの法則は、スイスの化学者GermainHによって作成されました。 熱化学の創始者の一人と見なされているヘス(1802-1850)。 彼の法律は言った:

つまり、ΔHは、次の式のように、試薬と生成物のエンタルピー値のみに依存します。
| ΔH=ΔH試薬 +ΔH製品 |
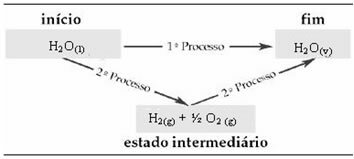
たとえば、1 molの水(H2O)は気体状態で水に変換されます。 この反応は2回実行されます。 ただし、異なるパスが選択されました。
(1回目)それは単一のステップで実行されました:
H2O(1) →H2O(v) ΔH= + 44 kJ
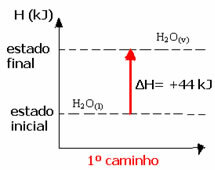
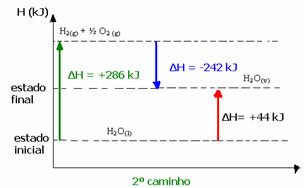
(2回目)2段階で実施しました。
最初のステップ:H2O(1) →H2(g) +½2(g) ΔH= + 286 kJ
第2段階:H2(g) +½2(g) →H2O(v) ΔH= -242 kJ
H2O(1) →H2O(v) ΔH= + 44 kJ
今やめないで... 広告の後にもっとあります;)
1つまたは2つのステップが実行されたかどうかに関係なく、エンタルピー変化(ΔH)は常に44kJであることに注意してください。 これは、ΔHがプロセスを構成するステップ、つまり中間プロセスのvaloresH値の代数和であるためです:
| ΔH=ΔH1 +ΔH2 +ΔH3 + ... |
たとえば、2番目のケースでは、反応の合計ΔHは、最初のステップのΔH(ΔH= +286 kJ)と2番目のステップのΔH(ΔH= -242 kJ)の合計でした。 したがって、1つのステップで同じ反応値が得られました。
ΔH=(+ 286 +(-242))kJ
ΔH=(+ 286 -242)kJ
ΔH= + 44 kJ
したがって、初期値と最終値のみに関心があります。 この場合、初期状態はHに対応します2O(1) そしてHの終わり2O(v).
特定の化学反応ではΔHを実験的に決定できないため、この法則は熱化学において非常に重要になっています。 ただし、ヘスの法則によれば、このタイプの反応のエンタルピーは、他の反応(中間反応)のエンタルピーから計算できます。
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "ヘスの法則"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/lei-hess.htm. 2021年6月28日にアクセス。