20ºCで100gの水を入れたグラスに10gの食卓塩(塩化ナトリウム-NaCl)を追加するとします。 混ぜると塩が完全に溶けたので、さらに塩を加えることにしました。 ある時点で、その量の水に塩を溶かすことができなくなり、どんなに激しく混ぜようとしても、追加された塩はガラスの底に沈みます。
それが起こったとき、私たちは解決策が 飽和 そしてそれは 溶解係数. したがって、溶解係数は次のように定義できます。
“溶解係数は、特定の温度で特定の量の溶媒に可溶化される溶質の最大量です。」
たとえば、塩の水への溶解係数は次のようになります。 20ºCで36gのNaCl / 100gの水。 この量の水とこの温度では、余分な1グラムの塩を溶かすことはできません。 溶解係数は各物質に固有です。 たとえば、溶質を変更した場合、食卓塩をNHに置き換えます4Cl、これはに等しい溶解係数を持っています 20°Cの100gの水に37.2g。
さらに、 同じ物質は異なる溶媒への異なる溶解度を持っています. 塩は水に溶けますが、アセトンや酢酸エチル(釉薬の除去に使用される溶剤)にはほとんど溶けません。
もう1つのポイントは、特定の量の溶媒への溶質の溶解係数が言及されている場合は常に、 温度も表示する必要があります、これは干渉要因であるため。 たとえば、20°Cで100gの水を取り40gの塩を加えると、36 gが可溶化し、4gが沈殿物を形成します。 しかし、この溶液を加熱すると、温度が上がると4gが溶解することがわかります。
これは、同じ量の溶媒に溶解した同じ溶質が、温度が上昇するにつれて異なる溶解係数を持つことを示しています。
今やめないで... 広告の後にもっとあります;)
以下の例を参照してください。
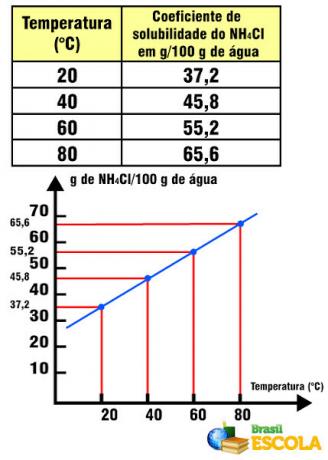
NH溶解係数4温度との関係でのCl
この場合、NHの溶解係数に注意してください。4Clは温度の上昇とともに増加します。 これは、水中のほとんどの塩で起こります。 ただし、Ceの場合のように、温度の上昇とともに溶解係数が低下する場合があります。2(のみ4)3. 食卓塩のように溶解係数に大きなばらつきがない場合もあります。 本文でこれを参照してください 溶解度曲線のグラフ.
特定の状況では、溶解係数よりも多い量の溶質を溶媒に溶解して、いわゆる 過飽和溶液。 たとえば、20°Cで100gの水と40gの食卓塩(36 g)で形成された溶液を想像してみてください。 溶解し、4 gが沈殿します)、すべての溶質がすべての溶質になる温度に達するまで加熱します 自分を溶かしてください。 次に、この溶液を静置して、20ºCに近い室温に達するまで冷却します。
溶液に乱れがない場合、余分な溶質は溶解したままになり、過飽和溶液を構成します。 ただし、このタイプの溶液は非常に不安定であり、突然の動きにより、その温度の溶解係数を超える量が結晶化する可能性があります。 したがって、だった解決策 過飽和 となります 背景のボディで飽和.
最後のケースは 不飽和溶液、これは、溶解した溶質の量が溶解係数の値よりも少ない場合です。 一例は、20℃で100gの水に10gのNaClを溶解することです。
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "溶解係数"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. 2021年6月28日にアクセス。