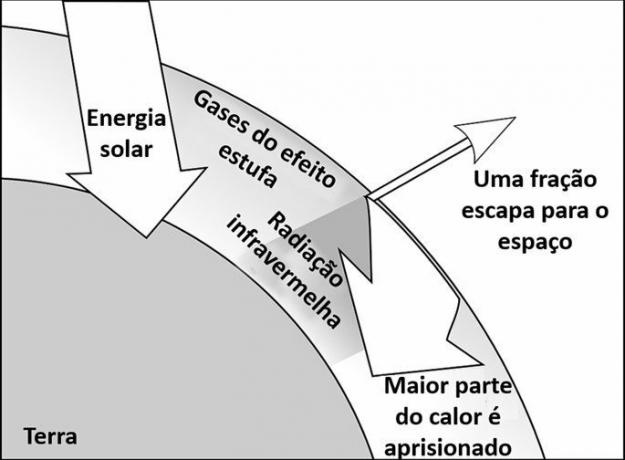
ガスが圧縮されると、なぜガスの圧力が上昇するのですか? この質問への答えは、密閉ボトル内のガス分子の動きに関するものです。以下を参照してください。
赤い粒子:気体状態の分子。
イラストを注意深く観察すると、より小さなスペースで分子がより集中していることがわかります。 ガスを圧縮すると、容器の壁に一定の圧力がかかり始めます。 壁に衝突する分子の急速で継続的な動きがこの現象を可能にします。
したがって、ガスの圧力を上げるために温度を上げる必要はなく、体積を減らす(ガスを圧縮する)だけです。
一方、平均運動エネルギー(Ecin)ガスの温度変化を促進する必要があります。
フラスコ内のガスを加熱すると、存在する分子がより速い速度で動き始め、平均運動エネルギーが増加します。 次に、Ecin 次の式に示すように、は温度に正比例します。
そしてcin = KT
この方程式に従うガスは、完全ガス(または理想気体)と見なされます。
今やめないで... 広告の後にもっとあります;)
リリア・アルベス
化学を卒業
ブラジルの学校チーム
続きを見る!
ガス –このクラスの化合物の詳細をご覧ください。
一般化学 - 化学 - ブラジルの学校
学校や学業でこのテキストを参照しますか? 見てください:
SOUZA、LíriaAlvesde。 "気体分子運動論"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/teoria-cinetica-dos-gases.htm. 2021年6月27日にアクセス。