電解 それは非自発的なプロセス、つまり自然には起こらないプロセスであり、水に溶けたり溶けたりした化合物の放電によって物質が形成されます。 このプロセスでは、電流は2つの不活性電極(影響を受けない、または影響を受けない)を備えたガラス容器(電解タンク)に到達します。 酸化 また 削減)グラファイトまたはプラチナで形成されています。 これらの電極は電源に接続されています(通常は ドラム)そして水に溶かした、または溶かした塩または塩基に浸した。 ちょうどのように 電池、電気分解には、カソード(還元が発生する場所)とアノード(酸化が発生する場所)があります。
概要
電気分解は非自発的なプロセスです。
単純または複合物質を形成することができます。
溶融溶質(火成電気分解)で発生する可能性があります。
これは、溶質が水に溶解した状態で発生する可能性があります(水電解)。
陽イオンは常に陰極で還元されます。
陰イオンは常に陽極で酸化されます。
も参照してください:電気分解からアルミニウムを得る

電気分解の種類
これは、溶融したイオン性化合物で放電が行われるときに発生する電気分解です。 イオン性化合物は、次のようなイオン結合によって形成される化合物です。 塩 または ベース 無機。 次に、溶融化合物について話すときは、固体から液体状態になる化合物を指します。
-火成電解の例
塩化カリウム(KCl)の融合を行うと、この塩は解離プロセスを経て、カリウムカチオン(K+)およびヨウ化物アニオン(l-).

塩化カリウムの解離式
これらのイオンで電流が電解槽に到達すると、カリウムカチオンが還元されて金属カリウム(K)が形成され、ヨウ化物アニオンが酸化されて固体ヨウ素(I2).
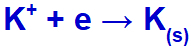
固体カリウム形成式
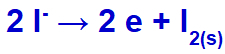
固体ヨウ素形成式
これは、塩または無機塩基によって形成された水溶液(水を含む)で放電が行われるときに発生する電気分解です。
-水性電解の例
塩化ナトリウムを水に溶かすと解離し、水はイオン化されます。

水のイオン化と塩化ナトリウムの解離方程式
ナトリウムカチオンとして(Na+)は、IAファミリーであるヒドロニウムカチオン(H+)放電を通過して還元され、水素ガス(H2).
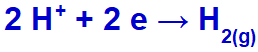
水素ガス生成式
塩化物として(Cl-)酸素化されておらず(酸素がない)、フッ化物ではない(F-)、それは排出され、酸化して塩素ガス(Cl2).

塩素ガス生成式
選択的イオン放電
水性媒体(水と溶質によって形成された溶液)での電気分解プロセス中、常に2つの陽イオンがあります。水からのヒドロニウムと、水からのその他の陽イオンです。 塩の解離 (溶質の例)。 また、2つの陰イオンがあります。水に由来するヒドロキシルと塩に由来するもう1つの陰イオンです。

水のイオン化と塩の解離によるイオン
-陽イオンと陰イオンの選択的放電
溶質からの陽イオンがIA、IIA、またはIIIAファミリーに属する場合、ヒドロニウム(H+)削減されます。
溶質に由来する陽イオンが上記のファミリーに属していない場合、還元を受けます。
溶質からの陰イオンがその組成に酸素を含んでいるか、フッ化物である場合(F-)、水酸化物(OH-)酸化を受けます。
-
溶質からの陰イオンが上記の特性を持たない場合、それは酸化を受けます。
今やめないで... 広告の後にもっとあります;)
水は自己イオン化してヒドロニウムイオン(H+)および水酸化物(OH-)、しかし、このイオン化はかなり制限されています。 この事実は、電流を伝導する際の純水の非効率性によって証明されています。
といった 電解 放電を伴い、水の電気分解を行うには、溶質を溶解する必要があります。 これは、ヒドロニウムと水酸化物の選択的排出に有利です(排出に関するトピックに見られるように) 選択的)。
硫酸ナトリウム(Na2のみ4)たとえば、中央にナトリウムカチオンがあります(Na+)およびヒドロニウム(H+)、および水酸化物アニオン(OH-)および硫酸塩(SO4-2). したがって、電流が電解タンクに到着すると、次のようになります。
ナトリウムはIAファミリーに属しているため、ヒドロニウムは排出され、還元されます。
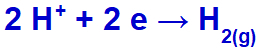
水素ガス生成式
硫酸塩はその組成に酸素を含んでいるため、水酸化物は放電して酸化します。
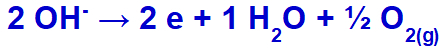
酸素ガス生成式
水から出る2つのイオン(陽イオンと陰イオン)が放出されたので、水の電気分解が起こったと言えます。
も参照してください: 電気分解の定量的側面
水素ガス(H2)、酸素ガス(O2)など;
水酸化ナトリウム(NaOH)、硫酸(H)などの複合物質の製造2のみ4)など;
銅(銅)や金(金メッキ)などの特定の金属で部品をコーティングする。
鉱石から特定の金属を取り除くために使用します。
電気分解に関する解決済みの演習
例1- (Vunesp)CuCℓの水溶液2 白金電極を使用して電気分解を行います。 正しいステートメントは次のとおりです。
a)カソードでCuイオンの還元が起こる2+.
b)アノードでCuイオンの酸化が発生する2+.
c)陰極で塩素ガスが発生します。
d)白金アノードの一部が溶解し、Ptを形成します2+.
e)CuClの電気分解の場合、この電気分解の生成物は異なります。2 燃えるような(融合)。
a)正解。 CuClの場合2 水に溶解すると、ヒドロニウムカチオン(H+)および銅II(Cu+2). 銅IIカチオンはIA、IIA、IIIAファミリーに属していないため、還元されます。
b)塩化物アニオン(Cl)がアノードで酸化されるため、誤り-)、その組成に酸素を含まず、フッ化物ではない(F-).
c)誤り、銅IIカチオンの還元はカソードで発生するため、銅金属が形成されます。
d)誤り、電気分解の白金またはグラファイト電極は電気を伝導するだけなので、プロセスには参加しません。
e)塩化銅II(CuCl2)存在するイオンは銅II(Cu)であるため、水性製品とまったく同じ生成物を提示します。+2)および塩化物(Cl-1).
例2- (UFRN)次のシステムを検討してください。
私。 溶融塩化ナトリウム;
II。 塩化ナトリウム水溶液;
III。 溶融水酸化ナトリウム;
IV。 水酸化ナトリウム水溶液。
電気分解を受けたときにナトリウムを提供できるものは次のとおりです。
a)IとIIのみ。
b)IとIIIのみ。
c)IIおよびIVのみ。
d)IIIおよびIVのみ。
e)I、II、IIIおよびIV。
カソードで生成物として金属ナトリウムを供給するシステムは、IとIIIです。
I-培地に存在する唯一の陽イオンはナトリウム陽イオンであるため、それだけが還元して金属ナトリウムを形成します。
II-このシステム 提供しません 塩化ナトリウムが水に溶解したため、金属ナトリウム、したがって、真ん中にナトリウムカチオン(Na+)およびヒドロニウム(H+)-ナトリウムはIAファミリーに属しているため、これは減少に苦しむ人です。
III-媒体に存在する唯一の陽イオンはナトリウム陽イオンであり(材料が融合されているため)、したがって、それだけが還元を受けて金属ナトリウムを形成します。
IV- このシステムは提供しません 水酸化ナトリウムが水に溶解したため、金属ナトリウム、したがって、真ん中にナトリウムカチオン(Na+)およびヒドロニウム(H+)-ナトリウムはIAファミリーに属しているため、これは減少に苦しむ人です。
私によって。DiogoLopesDias



