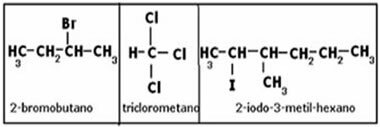
בפחמן ארבעה אלקטרונים בקליפת הערכיות שלו, מה שאומר שהוא יכול ליצור ארבעה קשרים, כך שהוא יכול לחבר אטומים אחרים. כמו: H, O, N, Cl. תכונה זו שיש לפחמן מסבירה את מגוון התרכובות האורגניות הקיימות בטבע, ולכן נאמר כי פחמן הוא טטרוולנטי.
בשנת 1874, Van't Hoff ו- Le Bel יצרו מודל מרחבי לפחמן. במודל זה היו אטומי פחמן המיוצגים על ידי טטרהדרונים רגילים, כאשר פחמן תופס את מרכז הטטרהדרון וארבעת הוואלנטים שלו תואמים לארבעת קודקודיו.

נוסחה מרחבית של פחמן.
במודל זה, סוגי הקשרים השונים המתרחשים בין אטומי פחמן יוצגו באופן הבא:
ה) קישור פשוט - טטרהדרונים מחוברים בקודקוד (קשר יחיד);


ב) קשר כפול - לטטרהדרונים מצטרפים שני קודקודים (קצה);


ג) קישור משולש - לטטרהדרונים מצטרפים שלושה קודקודים (פנים אחד);
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)


האבולוציה של המודל האטומי הראתה שלאטום יש גרעין ואלקטרוספרה, שאפשרו את הופעתם של מודלים חדשים כדי להסביר את הקשרים שנוצרו על ידי פחמן: בשנת 1915 הציג לואיס הצעה חדשה לקשירת האטומים של פַּחמָן. לדברי לואיס, אטומים נקשרים באמצעות זוגות אלקטרוניים בשכבת הערכיות. ייצוג זה נקרא הנוסחה האלקטרונית לואיס, וסוג הקשר בו אטומים מצטרפים באמצעות זוגות אלקטרוניים מכונה קשר קוולנטי.

פורמולה אלקטרונית של לואיס
הרוב המכריע של המולקולות האורגניות הן תלת ממדיות, ולכן יש צורך להשתמש במודלים שמראים לא רק את המבנה, אלא גם את הגיאומטריה. לכן הנוסחה המרחבית מתאימה יותר להבנת מבנה הפחמן.
מאת ליריה אלבס
בוגר כימיה
צוות בית הספר בברזיל
כימיה אורגנית - כִּימִיָה - בית ספר ברזיל
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
SOUZA, Líria Alves de. "נוסחאות מבניות פחמן"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/formulas-estruturais-carbono.htm. גישה אליו ב -28 ביוני 2021.