בְּ קשרים כימים הם האינטראקציות המתרחשות בין אטומים והופכות למולקולה או חומר בסיסי של תרכובת. ישנם שלושה סוגים של קישורים: קוולנטים, מתכתיים ו יונית. אטומים מבקשים, על ידי יצירת קשר כימי, לייצב את עצמם אלקטרונית. תהליך זה מוסבר על ידי תורת האוקטט, שמכתיב שלכל אטום, כדי להשיג יציבות, חייבים להיות שמונה אלקטרונים בקליפת הערכיות שלו.
אג"ח כימיות וכלל האוקטט
ה לחפש יציבות אלקטרונית, שמצדיק מימוש קשרים כימיים בין אטומים, מוסבר על ידי תורת האוקטט. המוצע על ידי ניוטון לואיס, תיאוריה זו קובעת כי האינטראקציה האטומית מתרחשת כך שכל יסוד רוכש יציבות של גז אצילי, כלומר שמונה אלקטרונים ב שכבת הערכיות.
בשביל זה, האלמנט לתת, לקבל או לשתף אלקטרונים מקליפתו החיצונית ביותר, ולכן יוצרים קשרים כימיים בעלי אופי יוני, קוולנטי או מתכתי. אתה גזים אצילים הם האטומים היחידים שכבר יש להם שמונה אלקטרונים בקליפה החיצונית ביותר ולכן הם לא מגיבים מאוד עם יסודות אחרים.
תראהגַם: כללי הפצה אלקטרונית: כיצד לעשות זאת?
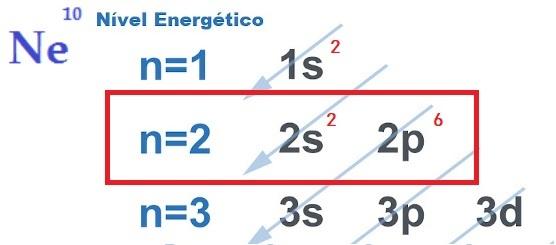
סוגי קשרים כימיים
כדי לקבל את שמונת האלקטרונים בקליפת הערכיות כפי שנחזה בכלל האוקטט, האטומים נקשרים יחד, המשתנים בהתאם לצורך לתרום, לקבל או לשתף אלקטרונים וגם לאופי אטומי הקשר.
קשרים יוניים
מוכר גם בשם קשרים אלקטרוולנטיים או הטרופולריים, לקרות בין מתכות ואלמנטים אלקטרוניים מאוד (אמטלים ומימן). בסוג זה של שיחות, מתכות נוטות לאבד אלקטרונים, הופך לקטיונים (יונים חיוביים), ואלקטרוני רווח לא-מתכות ומימן, הופכים לאניונים (יונים שליליים).
אתה תרכובות יוניות הם קשים ושבירים, בעלי נקודת רתיחה והתנהלות גבוהה זרם חשמלי כשהם במצב נוזלי או מדוללים במים.
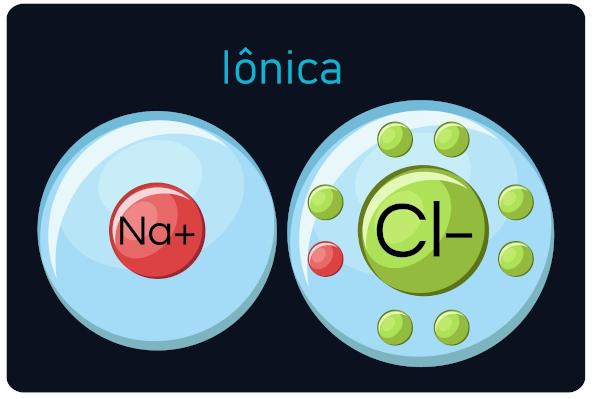
תַצְפִּית: שים לב שהאטום שצובר אלקטרונים יהפוך ליון סימן שלילי, והאטום שמאבד אלקטרונים הופך לסימן חיובי.
דוגמאות לחומרים יוניים:
- ביקרבונט (HCO3-);
- אמוניום (NH4+);
- סולפט (SO4-).
למידע נוסף על סוג זה של קשר כימי, בקר בטקסט שלנו: קשרים יוניים.
קשרים קוולנטיים
בְּ קשרים קוולנטיים לקרות על ידי שיתוף אלקטרונים. בשל ההבדל האלקטרוני-שלילי הנמוך בין האלמנטים המחייבים, הם אינם תורמים או מקבלים אלקטרונים, אלא שתף זוגות אלקטרוניים כך שהם יציבים על פי כלל האוקטט. סוג חיבור זה נפוץ מאוד באלמנטים פשוטים כמו Cl2, ח2, O2, וגם בשרשראות הפחמן. ההבדל של שליליות אלקטרונית בין הליגנדים קובע אם הקשר הוא קוטבי או לא קוטבי.

קרא גם:קוטביות של מולקולות: איך לזהות?
קשר קוולנטי דטיבי
המכונה גם לתאם קשר קוולנטי, קשר חצי-קוטבי, דטיבי או קואורדינטה, זה דומה מאוד לקשר קוולנטי, ההבדל בין השניים הוא שאחד האטומים בקשר הדאטיבי אחראי על שיתוף שני אלקטרונים. בסוג זה של חיבור, זה מתרחשת באופן מלאכותי, המולקולה רוכשת את אותם מאפיינים כמו מולקולה הנובעת מקשר קוולנטי ספונטני.
קישורי מתכת
סוג זה של קשר קורה בין מתכות, הכוללים את היסודות ממשפחת 1A (מתכות אלקליות), 2A (מתכות אדמה אלקליין) ומתכות המעבר (גוש B בטבלה המחזורית - קבוצה 3 עד 12), ויוצרים את מה שאנו מכנים סגסוגות מתכת. המאפיין הדיפרנציאלי ביחס לסוגי חיבור אחרים הוא ה- תנועת אלקטרונים, שמסביר את העובדה שחומרים מתכתיים, במצב מוצק, הם מוליכים חשמליים ותרמיים מצוינים. בנוסף, לסגסוגות מתכתיות יש נקודת התכה ורתיחה גבוהות, משיכות, יכולת גמישות וברק. דוגמאות לסגסוגות מתכת הן:
פלדה: ברזל (Fe) ופחמן C;
ארד: נחושת (Cu) + פח (Sn);
פליז: נחושת (Cu) + אבץ (Zn);
זהב: זהב (Au) + נחושת (Cu) או כסף (Ag).

סיכום
- קשרים כימים: אינטראקציה בין אטומים המחפשים יציבות אלקטרונית.
- סוגי קישורים: יונית, קוולנטית ומתכתית.
- חוק האוקטט: מגדיר שכדי שהאטום יהיה יציב, עליו להיות שמונה אלקטרונים בקליפת הערכיות שלו.
תרגילים נפתרו
שאלה 1 - (מקנזי-SP) כדי שאטומי גופרית ואשלגן יקבלו תצורה אלקטרונית השווה לזו של גז אצילי, יש צורך כי:
(נתונים: מספר אטומי S = 16; K = 19).
א) גופרית מקבלת 2 אלקטרונים ואשלגן מקבל 7 אלקטרונים.
ב) גופרית נותנת 6 אלקטרונים ואשלגן מקבל 7 אלקטרונים.
ג) גופרית מניבה 2 אלקטרונים ואשלגן מניב 1 אלקטרון.
ד) גופרית מקבלת 6 אלקטרונים ואשלגן מוותר על אלקטרון אחד.
ה) גופרית מקבלת 2 אלקטרונים ואשלגן מוותר על אלקטרון אחד.
פתרון הבעיה
חלופה E. מכיוון שגופרית נמצאת במשפחה 6A או 16, ומצייתת לכלל האוקטט, עליה לרכוש 2 אלקטרונים שיהיו להם 8 בקליפת הערכיות שלה. לעומת זאת, אשלגן, השייך למשפחה הראשונה של הטבלה המחזורית (1A או מימן), שיש בשכבת הערכיות שלו תצורה של גז אצילי, צריך לאבד אלקטרון אחד. על ידי שילוב של 2 אטומי אשלגן עם אטום גופרית אחד, אנו יכולים ליצור קשר יוני בו שני היסודות יציבים מבחינה חשמלית.
שאלה 2 - (UFF) חלב אם הוא מזון עשיר בחומרים אורגניים, כמו חלבונים, שומנים וסוכרים, וחומרים מינרליים כגון סידן פוספט. לתרכובות אורגניות אלו מאפיין עיקרי בקשרים קוולנטיים ביצירת המולקולות שלהן, ואילו למינרל יש גם קשר יוני. בדוק את האלטרנטיבה המציגה כראוי את המושגים של קשרים קוולנטיים ויוניים בהתאמה:
א) מליטה קוולנטית מתרחשת רק בתרכובות אורגניות.
ב) קישור קוולנטי נעשה על ידי העברת אלקטרונים, וקשר יוני נעשה על ידי שיתוף אלקטרונים עם ספינים מנוגדים.
ג) הקשר הקוולנטי נוצר על ידי משיכת מטענים בין אטומים, והקשר היוני נוצר על ידי הפרדת מטענים.
ד) הקשר הקוולנטי נוצר על ידי חיבור אטומים במולקולות, והקשר היוני, על ידי חיבור אטומים במתחמים כימיים.
ה) קישור קוולנטי נעשה על ידי שיתוף אלקטרונים, וקשר יוני נעשה על ידי העברת אלקטרונים.
פתרון הבעיה
חלופה E.
בואו נסתכל על האחרים:
- חלופה ל: שגויים כקשרים קוולנטיים מתרחשים גם בתרכובות אנאורגניות כגון CO2.
- אלטרנטיבה b: לא נכונה, שכן קשרים קוולנטיים מתרחשים על ידי שיתוף, וקשרים יוניים על ידי העברת אלקטרונים.
- אלטרנטיבה ג ': גם קשר קוולנטי וגם קשר יוניוני מתרחשים באמצעות הצורך לאבד או להשיג אלקטרונים, ולא באמצעות משיכה אלקטרוסטטית בין הגרעינים.
- חלופה ד: שני הקשרים, גם קוולנטיים וגם יוניים, מתרחשים באמצעות איחוד האטומים במולקולה.
שאלה 3 - (PUC-MG) סקור את הטבלה המציגה תכונות של שלושה חומרים, X, Y ו- Z, בתנאי הסביבה.
| חומר | טמפרטורת התכה (° C) | מוליכות חשמלית | מסיסות במים |
| איקס | 146 | אף אחד |
מָסִיס |
| y | 1600 | גָבוֹהַ | לֹא מָסִיס |
| z | 800 | פשוט נמס או מומס במים | מָסִיס |
בהתחשב במידע זה, נכון לקבוע כי חומרים X, Y ו- Z הם, בהתאמה:
א) יוני, מתכתי, מולקולרי.
ב) מולקולרי, יוני, מתכתי.
ג) מולקולרי, מתכתי, יוני.
ד) יוני, מולקולרי, מתכתי.
פתרון הבעיה
חלופה ג '.
חומר X הוא מולקולרי, כקשרים מולקולריים, הנקראים גם קוולנטים, יש להם נקודת רתיחה נמוכה, מכיוון שההבדל בין אלקטרגטיביות בין הליגנדים אינו גבוה מאוד. בדרך כלל לתרכובות קוולנטיות אין מוליכות חשמלית והמסיסות משתנה.
אנו יכולים לזהות חומר Y כמתכתי, שכן מתכות הן בעלות נקודת התכה גבוהה, הן מוליכות חשמליות מצוינות ואינן מסיסות במים.
לבסוף, חומר Z הוא יוני, מכיוון שנקודת ההיתוך גבוהה יחסית לחומר זה, שהיא תוצאה של הסדר הגבישי של המולקולה. כאשר חומר יוני מומס במים או במצב נוזלי, יש לו יונים חופשיים, מה שהופך אותו למוליך אלקטרונים ומסיס במים.
מאת ליסה ברנרדס מארקס
מורה לכימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm
