ה היווצרות אנלפיה, המכונה גם אנלפתיה סטנדרטית של היווצרות, או חום היווצרות סטנדרטי, הוא חישוב החום המשתחרר או נספג ביצירת 1 שומה של חומר מחומרים פשוטים, במצב הסטנדרטי.
אי אפשר לחשב את הערך המוחלט של האנטלפיות של כל חומר, אך ניתן לחשב את השונות באנטלפיה המתרחשת בתגובה באמצעות קלורימטר.
יש לזכור זאת הוסכם לאמץ את ערך האנטלפיה השווה לאפס עבור חומרים פשוטים במצב תקני. לפיכך, אם אנו רוצים לברר מהי האנטלפיה של היווצרות חומר, עלינו לדעת רק את ערך האנטלפיה של תגובת היווצרותו מחומרים פשוטים.
לדוגמא, אנו רוצים למצוא אנתלפיה של 18 גרם מים, התואמת ל- 1 מול, מכיוון שהמסה הטוחנת שלה היא 18 גרם למול. לשם כך, ראשית אנו זקוקים לתגובה ליצירת מים מחומרים פשוטים, כמוצג להלן:
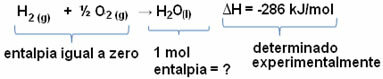
שים לב שערך השינוי באנטלפיה שהתרחש בתגובה זו נקבע בניסוי באמצעות קלורימטר ושווה ל- -286 קג''מ / מול.
הנוסחה המחשבת שינוי אנטלפי זה (ΔH) היא:
ΔH = Hמוצרים הריאגנטים
מכיוון שאנו כבר יודעים את הערך של ΔH וכי האנטלפיה של המגיבים שווה לאפס (מכיוון שהם חומרים פשוטים במצב תקני), נוכל להסיק שערך האנטלפיה של 1 מול מים שווה לשינוי האנתלפיה של תגובת היווצרות, מכיוון שהוא התוצר היחיד של אותה תגובה, כפי שמוצג לִגעוֹת:
ΔH = Hמוצרים הריאגנטים
-286 kJ / mol = HH2O - (חH2 + H1/2 או2)
-286 kJ / mol = HH2O - 0
הH2O = - 286 kJ / mol
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
סוג זה של אנטלפיה, המושג מאנתלפיה של חומרים פשוטים במצב תקני, הוא אפוא ה אנתלפיה יצירה סטנדרטית (ΔH0).
כעת, ישנם חומרים רבים שאינם נוצרים ישירות על ידי תגובה אחת, כגון מים. במקרים כאלה ניתן לחשב את אנלפיית היווצרות מתוך וריאציה של האנטלפיה של התגובה.
למשל, NH4Cl נוצר על ידי התגובה הבאה:
NH3 + HCl → NH4קל ΔH = -176 kJ / mol
שים לב שאף אחד מהמגיבים אינו חומר פשוט, ולכן איננו יכולים להקצות להם אנטלפיה של אפס. עלינו לדעת את האנטלפיות של היווצרות כל אחד מהריאגנטים, מכיוון שאלה נוצרים על ידי תגובות בין חומרים פשוטים:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92.4 kJ / mol
הוספת שתי האנטלפיות הללו נקבל את הערך של האנטלפיה של המגיבים ונוכל למצוא את האנתלפיה של NH4Cl:
הר = HNH3 + HHCl
הר = (-46 + (-92.4) kJ / mol)
הר = -138.4 kJ / mol
החלפה בנוסחה:
ΔH = Hמוצרים הריאגנטים
-176 = HNH4Cl - ( -138,4)
הNH4Cl = - 176 - 138,4
הNH4Cl = -314.4 kJ / mol
במקרה זה, סיכמנו ישירות את ערכי האנטלפיות של היווצרות המגיבים מכיוון שיחס התגובה היה 1 מול בלבד. עם זאת, אם בתגובות אחרות כמות השומות שונה, יהיה צורך להכפיל תחילה את האנטלפיה של היווצרות המגיב במספר השומות.
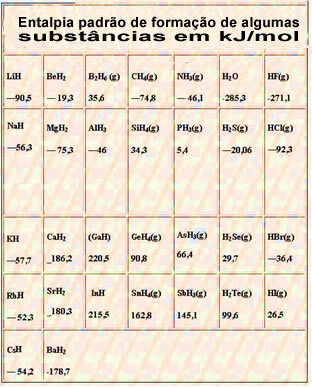
להלן טבלה עם האנתלפיה הסטנדרטית של היווצרות חומרים מסוימים בטמפרטורה של 25 מעלות צלזיוס ו -1 אטמוספירה:
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "אנתלפיה של גיבוש"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. גישה אליו ב -27 ביוני 2021.



