נקרא קרן יונים בגודל של יון. המחקר של מאפיין זה תלוי בידע אודות רדיוס אטומי ויונים.
רדיוס אטומי: הוא מדד לגודל האטום הנייטרלי (מרחק תיאורטי מהגרעין לאלקטרוספרה האחרונה).
יונים: אטומים שמאבדים (קטיונים) או צוברים אלקטרונים (אניונים).
פרוטונים בתוך הגרעין של א אָטוֹם להפעיל כוח אטרקטיבי על האלקטרונים (חלקיקים שליליים) הקיימים באלקטרוספירות. ככל שמספר הפרוטונים גדול יותר, כך המשיכה הזו גדולה יותר ולהיפך. כאשר מספר האלקטרונים באטום משתנה על ידי אובדן או רווח של חלקיקים אלה, המשיכה בין פרוטונים לאלקטרונים משתנה באופן הבא:
במקרה של קטיון:
מספר האלקטרונים באלקטרוספירות הופך להיות פחות ממספר הפרוטונים בתוך הגרעין, ה- מה שהופך את כוח המשיכה של הגרעין לגדול יותר, מקרב אליו את האלקטרונים. אלקטרוספירות. התוצאה היא ירידה ברדיוס האטום. לפיכך, רדיוס הקטיון תמיד יהיה קטן יותר מרדיוס האטום הנייטרלי שלו.
רדיוס אטום ניטרלי> רדיוס קטיון
במקרה של אניון:
מספר האלקטרונים באלקטרוספירות הופך גדול ממספר הפרוטונים שבתוך הגרעין. במקרה זה, כוח המשיכה המופעל על ידי הגרעין מתגבר על ידי כוח הדחייה בין האלקטרונים הקיימים באלקטרוספירות. התוצאה היא עלייה ברדיוס האטום. לפיכך, רדיוס האניון תמיד יהיה גדול יותר מרדיוס האטום הנייטרלי שלו.
רדיוס אניון> רדיוס אטום ניטרלי
שני המצבים המוצגים להלן הם דוגמה טובה למתרחש ברדיוס היון:
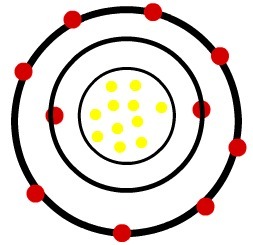
1) אטום נתרן ניטרלי (11Na) וקטיון הנתרן (11בְּ+)
בעוד שבאטום הנתרן הנייטרלי יש אחד עשר פרוטונים (כדורים צהובים) ואחד עשר אלקטרונים (כדורים אדומים), לקטיון הנתרן יש אחד עשר פרוטונים ועשרה אלקטרונים.

דגם אטום נייטרלי של נתרן
כאשר אטום הנתרן הנייטרלי מאבד אלקטרון, הרדיוס פוחת.
דגם של קטיון נתרן
תַצְפִּית: הרמה השלישית לא הייתה מיוצגת בתמונה של הקטיון מכיוון שכיוון שאיבדה את האלקטרון היחיד שהיה לה, היא הפכה ריקה ולכן היא לא התעלמה ממנה, אך היא קיימת.
2) אטום ניטרלי זרחן (15P) וקטיון הזרחן (15פ-3)
בעוד שבאטום הזרחן הנייטרלי יש חמישה-עשר פרוטונים (כדורים צהובים) וחמישה-עשר אלקטרונים (כדורים אדומים), לאניון הזרחן יש חמישה-עשר פרוטונים ושמונה-עשרה אלקטרונים.
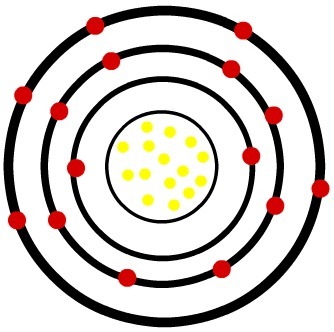
דגם של אטום זרחן ניטרלי
כאשר אטום הזרחן הניטרלי צובר שלושה אלקטרונים, הרדיוס גדל.
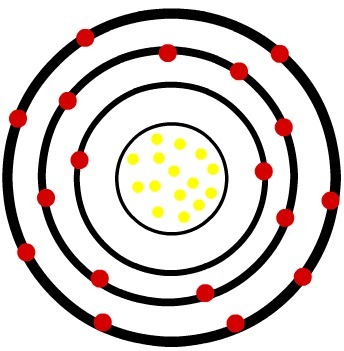
דגם של אניון של הזרחן
על ידי. דיוגו לופס דיאס
