בין המורכבויות של המחקר האטומי הוא קביעת גודל האטום, או יותר טוב - קרן אטומית. מאפיין תקופתי זה מתאר את המרחק מהגרעין לאלקטרון החיצוני ביותר של הרמות האלקטרוניות שלו. כדי לקבוע אותו מבצעים למשל חשבון אורך של המרחק בין הגרעינים של שני אטומים היוצרים חומר פשוט.
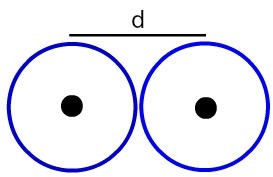
ייצוג המרחק בין שני גרעיני אטום
בואו נקבע את רדיוס אטומי (RA) של האטומים שמודגמים בתמונה. לשם כך פשוט חלק את המרחק בין הליבות ל -2:
RA = ד
2
או מחקר קרני אטום חשוב מכיוון שהוא מעדיף את ההבנה של אירועים פיזיים מסוימים (צפיפות, נקודת נקודה) היתוך, נקודת רתיחה ואנרגיית יינון) וכימיקלים (קשרים כימיים) המתרחשים עם אטומים.
על ידי ניתוח טבלה מחזורית, אנו יכולים להעריך אם אטום גדול יותר או קטן יותר ביחס לאחר, וכך לקבוע אם יש לו קלות יותר או פחות בהוצאת אלקטרונים אחד או יותר ממסלולם. ה הערכה וקביעת הרדיוס האטומי בטבלה המחזורית מבוצע על פי שני קריטריונים בסיסיים:
א) מספר רמות האנרגיה (משפחות או קבוצות / עמודות אנכיות)
אנו יודעים שלאטומים יכולים להיות עד שבע רמות אנרגיה (K, L, M, N, O, P, Q) ושכל אחד מהם יסוד כימי ממוקם במשפחות או קבוצות (עמודות אנכיות) ובתקופות (עמודות) אופקי). תקופות מציינות את מספר הרמות שיש לאטום היסודי, והמשפחה מציינת את רמת המשנה האנרגטית ביותר של האטום. בקבוצה או במשפחה, יסודות כימיים נבדלים בכמות רמות האנרגיה. ראה את הטבלה למטה:

ככל שמספר רמות האנרגיה של אטום גדול יותר, כך רדיוס האטום שלו גדול יותר. בניתוח הטבלה שלמעלה, ניתן לראות כי לפרנציום יש את האטום הגדול ביותר מכיוון שיש לו שבע רמות. לעומת זאת, לאטום האשלגן יש רדיוס קטן יותר מכיוון שיש לו ארבע רמות אנרגיה. להלן ייצוג השוואתי בין אטום הפרנציום לאטום האשלגן:
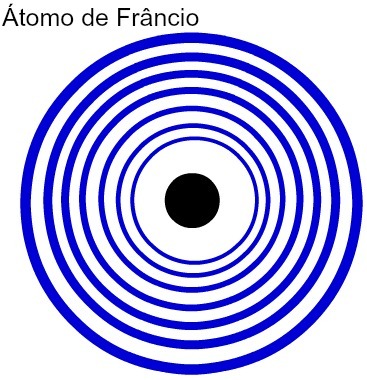
ייצוג של שבע רמות האנרגיה של אטום פרנסיום

ייצוג של ארבע רמות האנרגיה של אטום האשלגן
התרשים הבא מייצג כיצד גידול הרדיוס האטומי מתרחש באותה משפחה או קבוצה (עמודות אנכיות) של הטבלה המחזורית. ככל שמספר הרמות גדול יותר, כך הרדיוס גדול יותר, כלומר בטבלה המחזורית, רדיוס האטום גדל מלמעלה למטה:
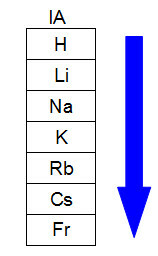
ייצוג כיצד גדל רדיוס האטום במשפחה של טבלה מחזורית
ב) מספר אטומי (Z או מספר פרוטונים) באותה תקופה (עמודה אופקית)
כאשר יסודות כימיים שייכים לאותה תקופה, לאטומים שלהם יש אותה כמות רמות אנרגיה, אך כמות הפרוטונים בתוך הגרעינים שלהם שונה. להלן רצף של אלמנטים השייכים לתקופה הרביעית בטבלה המחזורית:
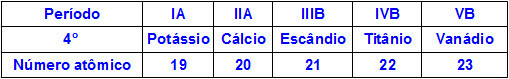
לכל האטומים של היסודות המיוצגים בטבלה לעיל יש ארבע רמות אנרגיה, אך לכל אחד מהם יש כמות שונה של פרוטונים בגרעינים שלהם. כאשר הפרוטונים שבתוך הגרעין מפעילים כוח מושך על האלקטרונים הנמצאים ברמות האנרגיה, ככל שכמות הפרוטונים בגרעין גדולה יותר, כך המשיכה שלהם כלפי אלקטרונים גדולה יותר. התוצאה היא קירוב של הרמות לכיוון הגרעין, מקטין את גודל האטום.
↑Z = ↓ רדיוס אטומי
↓Z = ↑ רדיוס אטומי
לפיכך, אנו יכולים לקבוע כי הרדיוס האטומי של היסוד אשלגן גדול יותר מזה של ונדיום בשל מספרם הפרוטונים הקטן יותר.
התרשים הבא מייצג כיצד גדל רדיוס האטום באותה תקופה (קו אופקי). ככל שהמספר האטומי קטן יותר, כך הרדיוס גדול יותר, כלומר הרדיוס האטומי בטבלה גדל מימין לשמאל
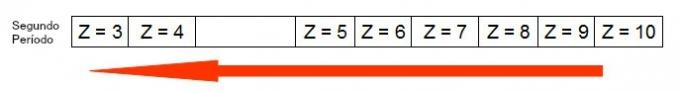
ייצוג של האופן בו רדיוס האטום גדל בתקופה של הטבלה המחזורית
על ידי. דיוגו לופס דיא


