בְּ כוחות בין-מולקולריים הם כוחות משיכה אלקטרוסטטיים שתפקידם לאחד מולקולות (תרכובות מולקולריות), לשמור אותם במצב מוצק או נוזלי. הם חשובים ביותר מכיוון שהם קובעים את כל המאפיינים הפיזיים (נקודת התכה, נקודת רתיחה, צפיפות ומסיסות) של חומרים.
בטקסט זה נלמד את הקשר בין כוחות בין-מולקולריים לבין נקודת הרתיחה של חומרים. בתחילה, נזכיר שלושה סוגים חשובים של כוחות בין-מולקולריים, שהם:
♦ דיפול דיפולהוא הכוח המתרחש במולקולות קוטביות. מכיוון שלמולקולות אלו יש קוטב חיובי ושלילי, כוח הדיפול-דיפול מבוסס על המשיכה שבין הקצה החיובי של מולקולה אחת לקצה השלילי של זו. דוגמאות: HCl, HBr, SO2 ו- PH3
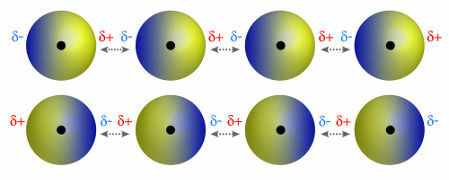
מולקולות בעלות מוט חיובי ושלילי המושכות זו את זו
♦ דיפול מושרההוא הכוח הבין-מולקולרי המתרחש רק במולקולות לא-קוטביות (אין להם קטבים). כאשר שתי מולקולות אפולריות מתקרבות, מתרחשת עיוות רגעי של העננים שלהן אלקטרונים, הגורמים לחוסר איזון באלקטרונים של המולקולה, המופצים ב- a שונה מבחינתה. באותו הרגע נוצר דיפול רגעי, ולמולקולה יש לרוב קוטב חיובי ושלילי, הגורם למשיכה. דוגמאות: CO2, CH4 ו- BH3
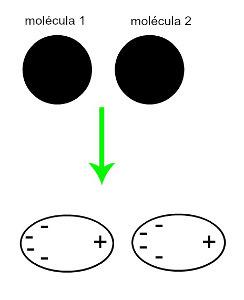
הגישה של שתי מולקולות לא קוטביות מייצרת דפורמציה, וכתוצאה מכך, חלוקה מחדש של אלקטרונים, היוצרת את הדיפולים הרגעיים.
♦ אג"ח מימןזהו הכוח הבין-מולקולרי המתרחש במולקולות קוטביות, אך רק בכאלה שיש בהם חובה אטומי מימן הקשורים ישירות לאטומי פלואור, חמצן או חנקן. זה יכול להיחשב לכוח דיפול-דיפול, אך בעוצמה הרבה יותר גדולה. האינטראקציה מתרחשת תמיד בין המימן של מולקולה אחת לאטום השונה (F, O, N) של מולקולה אחרת. דוגמאות: ח2או, NH3 ו- HF
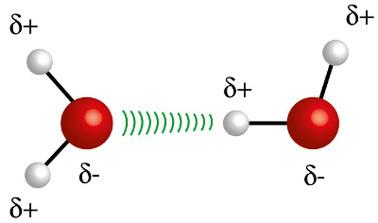
אטום המימן (כדור לבן) של מולקולה אחת מתקשר עם החמצן (כדור אדום) של מולקולת מים אחרת
לאחר שזכרנו את שלושת הכוחות הבין-מולקולריים, כעת אנו יכולים לקשר אותם לנקודת הרתיחה של החומרים. נקרא נקודת רתיחה הטמפרטורה בה מולקולות של חומר נתון מפסיקות להיות במצב נוזלי (כאשר הכוחות הבין-מולקולריים שלהם נשברים) ועוברים למצב גזי. הפרט המעניין הוא ש- כוחות בין-מולקולריים ונקודת הרתיחה לחומרים יש קשר אינטנסיבי וישיר מאוד, מכיוון שככל שהכוח הבין מולקולרי עז יותר, כך נקודת הרתיחה גבוהה יותר. סדר העוצמה של הכוחות הבין מולקולריים הוא:
דיפול המושרה
לפיכך, אנו יכולים להסיק כי למולקולות שיש להן קשרי מימן ככוח אינטראקציה יש נקודות רתיחה גבוהות יותר מאלו שיש להן דיפול-דיפול וכן הלאה. הטבלה שלהלן מציגה שלושה חומרים וערכי נקודת הרתיחה שלהם:
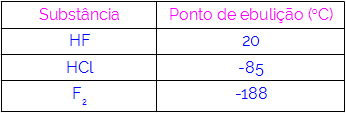
אנו מתבוננים בטבלה כי ל- HF יש נקודת רתיחה גבוהה יותר, מכיוון שמולקולותיה מחוברות לקשרים מימן. חומר F2 יש לו את נקודת הרתיחה הנמוכה ביותר, שכן המולקולות שלה נמשכות על ידי דיפול המושרה.
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm



