למד ליישם את החוק הראשון של התרמודינמיקה במצבים שונים, לפתור תרגילים ולבדוק את הידע שלך באמצעות תרגילים פתורים ומוסברים.
שאלה 1
החוק הראשון של התרמודינמיקה קובע כי:
א) לא ניתן ליצור או להרוס אנרגיה, אך ניתן להמיר אותה מצורה אחת לאחרת.
ב) אנרגיה נשמרת תמיד, אך לא ניתן להמיר אותה מצורה אחת לאחרת.
ג) ניתן ליצור או להרוס אנרגיה, אך לא ניתן להמיר אותה מצורה אחת לאחרת.
ד) לא ניתן לשמר אנרגיה, אך ניתן להמיר אותה מצורה אחת לאחרת.
החוק הראשון של התרמודינמיקה הוא עקרון שימור האנרגיה, כך במערכת סגור, כמות האנרגיה נשארת קבועה וניתן להפוך אותה רק מצורה אחת לאחרת. אַחֵר.
שאלה 2
נניח מערכת סגורה שמקבלת 100 J של חום תוך כדי עבודה של 50 J. מהו השינוי באנרגיה הפנימית של המערכת?
א) -50 J
ב) 0 י
ג) 50J
ד) 100J
ה) 150J
בודקים את השלטים:
החום המתקבל הוא Q חיובי > 0.
העבודה שנעשתה היא חיובית W > 0.
על פי החוק הראשון, יש לנו:
שאלה 3
מערכת גז אידיאלית מחליפה חום של 500 ג'אול עם הסביבה החיצונית. בהנחה שתהליך זה הוא קירור איזומטרי, קבע את העבודה והאנרגיה הפנימית, בהתאמה.
א) 500 J ו-0 J
ב) - 500 ו-0 J
ג) 0 J ו-500 J
ד) 0 J ו - 500 J
ה) -500 J ו-500 J
מכיוון שהתהליך הוא איזומטרי, אין שינוי בנפח, ולכן העבודה היא אפס.
לפי החוק הראשון של התרמודינמיקה:
מכיוון שמדובר בקירור, המערכת מאבדת חום, לכן:
שאלה 4
8 מולים של גז אידיאלי במערכת בוכנה-צילינדר נדחסים על ידי ביצוע 1000 J של עבודה. במהלך התהליך, 400 J של חום הולכים לאיבוד לסביבה החיצונית. האנרגיה הפנימית שלו והשינוי בטמפרטורה שלו שווים בהתאמה ל
נתון: R = 8.31 J/mol. ק
א) - 1400 J ושינוי משוער של 6 K
ב) 600 J ושינוי משוער של 6 K
ג) 600 J ושינוי משוער של 14 K
ד) - 1400 J ושינוי משוער של 14 K
אנרגיה פנימית
כאשר המערכת מקבלת עבודה, הסימן שלה הוא שלילי, כמו גם החום, אשר בתהליך זה אובד.
החוק הראשון של התרמודינמיקה הוא:
בהחלפת הערכים נקבל:
R = 8.31 J/mol K
טֶמפֶּרָטוּרָה
לפי חוק ג'ול, יש לנו:
שאלה 5
גז מושלם עובר דחיסה, עושה 500 J של עבודה. בסוף השינוי הזה, האנרגיה הפנימית של המערכת השתנתה ב-200 J פחות מאשר בהתחלה. כמות החום שהחליף הגז הייתה
א) - 700 J
ב) - 300 J
ג) 300J
ד) 0J
ה) 700 J
מאחר שהעבודה התקבלה, כלומר עבודה עמידה, הסימן שלה הוא שלילי.
החלפת הערכים במשוואת החוק הראשון של התרמודינמיקה:
שאלה 6
(CEDERJ 2021) בשלב של המחזור המבוצע על ידי גז אידיאלי במזגן, לחץ הגז מוגבר תוך שמירה על נפח קבוע. בשלב זה של המחזור, העבודה W שעושה הגז, כמות החום Q שנספגת בו והשינוי ΔT בטמפרטורה שלו הם, בהתאמה:
א) W < 0, Q < 0 ו-ΔT < 0
ב) W = 0, Q > 0 ו- ΔT > 0
ג) W = 0, Q = 0 ו- ΔT = 0
ד) W > 0, Q > 0 ו-ΔT > 0
נתונים:
הלחץ P עולה;
נפח נשאר קבוע;
עֲבוֹדָה
מכיוון שהנפח קבוע, העבודה W שווה לאפס.
החוק הראשון של התרמודינמיקה הולך כך:
מכיוון שחום חיובי, גם השינוי באנרגיה הפנימית יהיה חיובי.
חוֹם
מכיוון שחום נספג, הוא חיובי.
טֶמפֶּרָטוּרָה
לפי חוק הגז:
איפה,
n הוא מספר השומות
R הוא קבוע הגז האוניברסלי
לפיכך, הטמפרטורה תלויה רק בלחץ, שכן הנפח קבוע, בהיותו חיובי.
שאלה 7
(UNICENTRO 2018) על פי החוק הראשון של התרמודינמיקה, השינוי באנרגיה הפנימית של מערכת, ΔU, הוא ניתן על ידי ההבדל בין החום שהוחלף עם הסביבה החיצונית, Q, לבין העבודה, W, שנעשתה בתהליך תרמודינמית. בהתחשב במידע זה, אם גז מונוטומי מתרחב כך שיישאר תמיד באותה טמפרטורה, ניתן לייצג טרנספורמציה זו באמצעות המשוואה
א) ΔU + W = 0
ב) ΔU − W =0
ג) Q − W = 0
ד) Q + ΔU = 0
תהליך איזותרמי מתרחש ללא שינוי טמפרטורה.
אנרגיה קשורה לטמפרטורה על ידי:
כאשר n הוא מספר השומות ו-R הוא קבוע הגז האוניברסלי. מכיוון ש- n ו-R קבועים, יש רק שינוי בטמפרטורה, ו
החוק הראשון של התרמודינמיקה הולך כך:
שאלה 8
(URCA 2016) על פי החוק הראשון של התרמודינמיקה אם במהלך תהליך איזותרמי שעובר גז אידיאלי בעל מסה קבועה, הגז משתחרר כמות חום שגודלה הוא 50 קלוריות אז השינוי באנרגיה הפנימית והעבודה שעשה הגז בתהליך זה הם, בהתאמה:
א) 0 ו-50 קלוריות
ב) 50 קלוריות ו-0.
ג) 0 ו-0.
ד) 50 קלוריות ו-50 קלוריות.
ה) 0 ו-50 קלוריות
השינוי באנרגיה הפנימית קשור ישירות לשינוי בטמפרטורה. מכיוון שהתהליך הוא איזותרמי, אין שינוי בטמפרטורה, אז .
מהחוק הראשון של התרמודינמיקה:
מכיוון שהחום משתחרר, הסימן שלו שלילי.
שאלה 9
(UFRN 2012) ביומסה היא אחד המקורות העיקריים של אנרגיה מתחדשת, ולכן, מכונות המשתמשות בה כדלק לייצור חשמל חשובות מנקודת מבט סביבתית. דוגמה נפוצה מאוד היא השימוש בביומסה להנעת טורבינת קיטור לייצור עבודה. האיור בצד מציג באופן סכמטי תחנת כוח תרמו-חשמלית פשוטה.
במפעל תרמו-אלקטרי זה, שריפת ביומסה בכבשן מייצרת חום, המחמם את המים בדוד ומייצר קיטור בלחץ גבוה. הקיטור, בתורו, מועבר דרך צינורות אל הטורבינה אשר, תחת פעולתה, מתחילה לסובב את להביה.
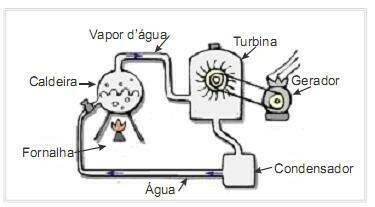
נניח שהפסדי חום עקב הפרשי טמפרטורה בין חלקי מנוע חום זה לבין הסביבה יהיו זניחים. בהקשר זה, השונות באנרגיה הפנימית של מי הדוד
א) גדול מסכום החום המסופק לו משריפת הביומסה והעבודה על הטורבינה.
ב) שווה לסכום החום המסופק לו משריפת הביומסה עם העבודה על הטורבינה.
ג) שווה להפרש בין החום המסופק לו בשריפת הביומסה לבין העבודה שנעשתה על הטורבינה.
ד) גדול מההבדל בין החום המסופק לו משריפת הביומסה לבין העבודה שנעשתה על הטורבינה.
המים בדוד מקבלים אנרגיה בצורת חום משריפת הדלק ומשחררים אנרגיה בצורת עבודה הנעשית על הטורבינה.
שאלה 10
(UECE 2021) בנוגע לתכונות של גזים, שימו לב להצהרות הבאות:
אני. עבור גז אידיאלי, אנרגיה פנימית היא פונקציה של לחץ בלבד.
II. החום שסופג גז בעת שינוי מצבו אינו תלוי בתהליך.
III. האנרגיה הפנימית של גז אידיאלי היא פונקציה של טמפרטורה בלבד ואינה תלויה בתהליך.
IV. בהתפשטות איזותרמית של גז אידיאלי, העבודה הנעשית על ידו שווה לחום שנספג.
זה נכון מה שנאמר רק ב
א) I ו-II.
ב) ג' ו-ד'.
ג) I ו-IV.
ד) ב' ו-ג'.
III. נכון. האנרגיה הפנימית של גז אידיאלי היא פונקציה של טמפרטורה בלבד ואינה תלויה בתהליך.
השינוי באנרגיה הפנימית קשור ישירות לשינוי בטמפרטורה.
כאשר n הוא מספר השומות ו-R הוא קבוע הגז האידיאלי, בהיותו קבועים, רק הטמפרטורה קובעת את האנרגיה הפנימית של הגז.
IV. נכון. בהתפשטות איזותרמית של גז אידיאלי, העבודה הנעשית על ידו שווה לחום שנספג.
מכיוון שהוא איזותרמי, אין שינוי בטמפרטורה, ולכן השינוי באנרגיה הפנימית הוא אפס. לפי החוק הראשון של התרמודינמיקה:
למידע נוסף באמצעות:
- החוק הראשון של התרמודינמיקה
- תרמודינמיקה: חוקים, מושגים, נוסחאות ותרגילים
- תרגילים על תרמודינמיקה
- חוק הגז
ASTH, רפאל. תרגילים של החוק הראשון של התרמודינמיקה.הכל עניין, [נ.ד.]. אפשר להשיג ב: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. גישה ב:
ראה גם
- תרגילים על תרמודינמיקה
- תֶרמוֹדִינָמִיקָה
- טרנספורמציה אדיאבטית
- תרגילים על תרמוכימיה
- החוק הראשון של התרמודינמיקה
- מדעי הטבע והטכנולוגיות שלהם: אנם
- אנרגיית תרמית
- החוק השני של התרמודינמיקה