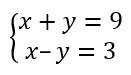O המודל האטומי של שרדינגר היא צורה נפוצה המשמשת לציון תיאור האטום על ידי פתרון משוואת שרדינגר, שהוצע על ידי הפיזיקאי האוסטרי ארווין שרדינגר ב-1927. המשוואה נוצרה על סמך תצפיות חשובות שהושגו בתוך מכניקת הקוונטים, מה שמביא הצדקה חזקה לאנרגיה של האטום והאלקטרון.
האטום שהגה שרדינגר מבוסס על דואליות גל-חלקיק, על עקרון אי הוודאות, בין שאר המושגים שנטבעו בתחילת המאה ה-20. היא הביאה התקדמות גדולה בהבנת החומר, שכן היא סללה את הדרך להבנה מוצקה יותר של אטומים פוליאלקטרוניים, דבר שאינו אפשרי עם המודל האטומי שהציע בוהר.
קרא גם: מודלים אטומיים - המודלים המוצעים כדי להסביר את מבנה האטום
נושאי מאמר זה
- 1 - סיכום המודל האטומי של שרדינגר
- 2 - מהו המודל האטומי של שרדינגר?
-
3 - בסיס ניסוי למודל האטומי של שרדינגר
- אפקט פוטואלקטרי
- דואליות גל-חלקיק
- עקרון אי - הוודאות
- 4 - מאפייני המודל האטומי שרדינגר
- 5 - התקדמות המודל האטומי של שרדינגר ביחס למודלים אטומיים אחרים
סיכום על המודל האטומי של שרדינגר
המודל האטומי של שרדינגר הוא למעשה התיאור של האטום והאלקטרונים באמצעות משוואת שרדינגר.
משוואת שרדינגר פותחה באמצעות מחקרים חשובים בתחום מכניקת הקוונטים.
דואליות הגל-חלקיקים, עקרון אי הוודאות, בין תיאוריות אחרות, היו חיוניים ליצירת משוואת שרדינגר.
בפתרון משוואת שרדינגר, אפשר לתאר את האנרגיה של האטום וגם את זו של האלקטרון.
בהתבסס על הפרשנות של משוואת שרדינגר, ניתן לראות שאין לאלקטרונים מסלול מוגדר סביב האטום, אלא אזור של הסתברות לקיום מסביב ממנו.
מחקריו של שרדינגר מרחיבים את ה הבנת האטום שהציע בוהר, שכן הם מאפשרים הבנה של התנהגות אטומים פוליאלקטרוניים.
מהו המודל האטומי של שרדינגר?
המודל האטומי שרדינגר הוא שם נפוץ ל תיאור של מודל אטומי המבוסס על מכניקת הקוונטים. המאפיין העיקרי של מודל זה הוא הפרשנות המתמטית של דואליות הגל-חלקיקים שאומצה על ידי אלקטרונים, יותר באופן ספציפי, החלפת מסלול מוגדר היטב של האלקטרון בהסתברות לקיומו של האלקטרון סביב הליבה.
פרשנות כזו החלה דרך עבודתו של המדען האוסטרי ארווין שרדינגר, בשנת 1927, לאחר התקדמות חשובה. בהבנת חומר בתחום מכניקת הקוונטים, כגון האפקט הפוטואלקטרי, עקרון אי הוודאות והדואליות גל-חלקיק.
ההבנה של המודל האטומי של שרדינגר אינה טריוויאלית, מכיוון שהיא מתקרבת לרמות מתקדמות יותר של חקר הכימיה.
אל תפסיק עכשיו... יש עוד אחרי הפרסום ;)
בסיס ניסוי למודל האטומי של שרדינגר
לפני מחקריו של ארווין שרדינגר, היו התקדמות חשובות בתחום הבנת החומר בתחילת המאה ה-20. ניסויים כאלה יזמו את תחום הידע התיאורטי המכונה מכניקת הקוונטים, המביא פרשנויות לגבי התנהגותם של חלקיקים קרובים או מתחת לסולם האטומי. ביקום הספציפי הזה, חוקי הפיזיקה הקלאסית, הידועים גם בשם הפיזיקה הניוטונית, לרוב אינם חלים או אינם מספיקים כדי להסביר התנהגויות מסוימות.
רק כדי לקבל מושג, אנחנו יכולים לומר שמכניקת הקוונטים מתחילה עם נושא המכונה אסון האולטרה סגול. לפי הפיזיקה הקלאסית, גוף שחור (עצם חם), עם טמפרטורה שונה מאפס, פולט קרינה אולטרה סגולה עזה, בנוסף לקרינת גמא וקרני רנטגן.
זה אומר שאנחנו בני האדם, עם הטמפרטורה שלנו של 36-37 מעלות צלזיוס, היינו זוהרים בחושך (תוצאה של ליבון). מיותר לציין שמדובר בשטויות גמורות, שהרי אם זה היה, לא היה חושך.
בהקשר הזה, בשנת 1900, מקס פלאנק יצר את הרעיון של כמה, מתורגם כ"חבילות אנרגיה", על מנת להסביר את חילופי האנרגיה בין חומר לקרינה. לפי הפרשנות שלו, לגוף בטמפרטורות נמוכות (כמונו) אין מספיק אנרגיה כדי לפלוט קרינה אולטרה סגולה בתדירות גבוהה.
לפיכך, גוף יכול לפלוט קרינה אולטרה סגולה בתדר גבוה רק כאשר הוא רוכש את האנרגיה המינימלית הדרושה. במצב זה, חילופי האנרגיה בין החומר לסביבה מתרחשים באמצעות חבילות של אנרגיית קרינה.
גם מנות אנרגיה מביאות הבדל ביחס לפיזיקה הקלאסית. כשמדברים על חבילות אנרגיה, הכוונה היא לאנרגיה שמקובלת בכימות, כלומר, זה ספציפי, יש הטלת גבולות. בפיסיקה הניוטונית, לכמות האנרגיה המוחלפת בין שני עצמים אין הגבלות.
אפקט פוטואלקטרי
כדי לתת חוסן לתיאוריות שהציע פלאנק, היה צורך בראיות נוספות. בהקשר זה הופיע האפקט הפוטואלקטרי., העוסקת בפליטה של אלקטרונים ממתכת באמצעות שכיחות קרינה אולטרה סגולה על פניה.
על פי התצפיות של תיאוריה זו, לא נפלטים אלקטרונים עד שהקרינה מגיעה לתדר של ערך מסוים, ספציפי לכל מתכת. ברגע שמגיעים לתדר זה, האלקטרונים נפלטים מיד, וככל שתדירות הקרינה הנכנסת חזקה יותר, כך האלקטרון הנפלט יהיה מהיר יותר.
א ההסבר לאפקט הפוטואלקטרי ניתן על ידי אלברט איינשטיין. לפי איינשטיין, קרינה אלקטרומגנטית (אור, למשל, היא קרינה אלקטרומגנטית), המשמשת לפליטת אלקטרונים, הייתה מורכבת מ חלקיקים המכונים פוטונים, ויתרה מכך, כל פוטון יכול להתפרש כחבילת אנרגיה. בהתבסס על מחקריו של פלאנק, ניתן היה להסיק שפוטונים של קרינה אולטרה סגולה הם אנרגטיים יותר מפוטונים של אור נראה.

כאשר מתנגשים עם פני המתכת, הפוטונים (מרכיבי הקרינה האלקטרומגנטית) מחליפים אנרגיה עם האלקטרונים הנמצאים שם. אם האנרגיה שסופגת האלקטרון מהתנגשות בפוטונים גדולה מספיק, אז היא תיפלט. למידע נוסף על האפקט הפוטואלקטרי, לחץ כאן.
דואליות גל-חלקיק
האפקט הפוטואלקטרי הביא בסיס חזק לכך שקרינה אלקטרומגנטית מורכבת מחלקיקים (פוטונים). עם זאת, ניסויים רבים אחרים הצביעו על כך שקרינה אלקטרומגנטית התנהגה כמו גל. מבין הניסויים הללו, הבולט ביותר היה דיפרקציה - התופעה הפיזיקלית הנצפית כאשר גל נתקל במכשול או, לפי פרשנות אחרת, יכולת של גלים להתגבר על מכשולים.
O אופי הגל של האור ידוע מאז 1801, כשהפיזיקאי האנגלי תומס יאנג האיר אור על מחסום עם חריץ. כאשר הוא עובר דרך חריץ זה, האור עובר עקיפה. בכל חריץ, כולל, שהאור עובר, אפילו מתעקם, הוא עובר עקיפה חדשה.

ככה, היה צורך לקבל התנהגות חדשה לקרינה אלקטרומגנטית: דואליות הגל-חלקיק. משם, המדען הצרפתי לואי דה ברולי הרחיב את המושג הזה, והציע כי יש להבין את כל החלקיקים גם כבעלי התנהגות גלים.
השערת דה ברולי התחזקה בשנת 1925, כאשר המדענים האמריקאים קלינטון דייוויסון ולסטר גרמר הוכיח שקרן אלקטרונים מסוגלת לעבור עקיפה כאשר היא עוברת דרך גביש בודד של ניקל.
תפיסה זו הייתה חיונית כדי להגיע למסקנה שחלקיקים כבדים יותר, כגון מולקולות, מסוגלים גם הם לעבור עקיפה, ולכן, להפגין התנהגות כמו גל. למידע נוסף על דואליות גל-חלקיק, לחץ כאן.
עקרון אי - הוודאות
בפיזיקה הקלאסית, קל לך לקבוע את המסלול של חלקיק. עם זאת, בעולם הקוונטי, שבו גם חלקיקים מתנהגים כמו גלים, המסלול שלהם כבר לא כל כך מדויק. זה בגלל אין טעם לדבר על מיקומו של גל.
לדוגמא, בגיטרה, כאשר תולשים מיתר, הגל מתפשט לכל אורכו. אם לחלקיק יש את אותה התנהגות, אין דרך להגדיר את מיקומו בדיוק, אפילו לדעת המומנטום הליניארי שלו (כמות שמערבבת מסה ומהירות).
לכן, לאלקטרון, שגם לו אופי כפול, אין מסלול/מסלול מוגדר סביב גרעין האטום, כפי שסבורים רבים. אהדואליות יוצרת אז אי ודאות לגבי מיקומו המדויק של החלקיק.
אי ודאות זו בהגדרת המיקום היא זניחה עבור גופים כבדים מאוד, אך משמעותית לחלוטין עבור גופים בגודל אטומי או תת-אטומי, כלומר, אם אתה יודע שהחלקיק נמצא במקום מסוים, ברגע מסוים, לא תדע יותר היכן הוא יהיה ברגע הבא רֶגַע.
מתוך דילמה זו צמח עקרון אי הוודאות., שהוקם על ידי הפיזיקאי הגרמני ורנר הייזנברג ב-1927. לפי עיקרון זה, לא ניתן לדעת את מיקומו והתנע הליניארי של חלקיק ללא מרווח שגיאה, כלומר אם תכונה אחת ידועה, השניה לא. למידע נוסף על עקרון אי הוודאות, לחץ כאן.
תכונות של המודל האטומי של שרדינגר
מכיוון שמאופיו הכפול של החלקיק לא ניתן היה להגדיר עוד מסלול ספציפי עבורו, בשנת 1927, המדען האוסטרי ארווין שרדינגר החליף את המסלול המדויק הזה בפונקציית גל, המיוצגת על ידי האות היוונית psi (ψ), כאשר הערכים של פונקציה זו משתנים בהתאם למיקום. דוגמה לפונקציית גל היא פונקציית הסינוס של איקס.

המדען מקס בורן יצר אז פרשנות פיזיקלית לפונקציית הגל, וקבע כי ריבוע הפונקציה ψ, כלומר ψ², יהיה פרופורציונלי להסתברות למצוא חלקיק ב- אזור. לפיכך, ψ² מובנת כצפיפות ההסתברות למציאת חלקיק באזור כלשהו. מכיוון שמדובר בצפיפות הסתברות, יש להכפיל את הערך של ψ² בנפח כדי לקבל את ההסתברות האמיתית.
כדי לחשב את פונקציית הגל, שרדינגר פיתח משוואה, בפשטות כדלקמן:
Hψ = Eψ
יש לקרוא את Hψ כ"המילטוניאן של psi", ומתאר את העקמומיות של פונקציית הגל. המילטון הוא אופרטור מתמטי, בדיוק כמו הפלוס, מינוס, יומן וכו'. הצד הימני מביא לנו את האנרגיה המתאימה.
הפתרון של משוואה זו מביא לנו מסקנה חשובה: לחלקיקים יכולים להיות רק אנרגיות בדידותs, כלומר, אנרגיות מוגדרות היטב, או כמותיות, ולא כל ערך. ערכי אנרגיה ספציפיים אלו ידועים כרמות אנרגיה. זוהי הטלת פונקציית הגל, מכיוון שהיא צריכה להתאים לאזור מסוים בחלל. במכניקה הקלאסית, לאובייקט יכול להיות כל ערך של אנרגיה כוללת.
ככה, לאלקטרון אין שום אנרגיה, אבל רמות אנרגיה מוגדרות היטב. מכיוון שפונקציית הגל צריכה להתאים לאזור במרחב, זכור כי א האלקטרון כלוא בתוך אטום באמצעות כוחות המשיכה שיש לו לגרעין.
ניתן לחשב את רמות האנרגיה של אטום על ידי פתרון מתאים של משוואת שרדינגר. במקרה זה, ניתן לשים לב שהרזולוציה מגיעה למשוואה חדשה, המדגימה כי האנרגיה של כל רמה באטום תלויה במספר שלם, הנקרא נ, מה שמאשר את הרעיון שלרמות האנרגיה יש ערכים ספציפיים.
לפיכך, הקצאת ערכים חיוביים ל נ (1, 2, 3...), אפשר לחשב את האנרגיה של הרמות האטומיות. הפרמטר נ נקרא כעת המספר הקוונטי העיקרי, מכיוון שהוא בסופו של דבר מקושר לכל רמה אטומית המותרת לאטום.
אל ה פונקציות של גל אלקטרוני נקראות אורביטלים אטומיים, שהביטויים המתמטיים שלו מתקבלים גם על ידי פתרון משוואת שרדינגר. מסלול אטומי מציג את התפלגות האלקטרון באטום, כלומר, אזור ההסתברות לקיומו של אלקטרון באטום. לאורביטלים אטומיים יכולים להיות צורות ואנרגיות שונות, המתקבלות גם על ידי משוואת שרדינגר.
לכל רמת אנרגיה נ (זוכרים את זה נ יכול להיות 1, 2, 3...), יש נ רמות משנה. בכל תת-רמה, ישנם אורביטלים בצורות שונות. אין גבול לאורביטלים השונים, אבל עם האטומים הידועים עד כה, כימאים משתמשים רק בארבעה מהם, המזוהים באמצעות האותיות ס, פ, ד זה ו.
כך, למשל, ברמה נ = 1, יש רק תת-רמה אחת, אז יש רק את האורביטל ס. עכשיו לרמה נ = 2, ישנן שתי רמות משנה, האורביטלים נמצאים ס זה פ.

התקדמות המודל האטומי של שרדינגר ביחס למודלים אטומיים אחרים
כפי שהוזכר, שרדינגר לא הציג בהכרח מודל אלא פרשנות מתמטית. לתופעות שנצפו הנוגעות לאופי החלקיקים. לכן פרשנותו הופכת למורכבת, שכן משוואת שרדינגר עצמה זקוקה לידע מתמטי מתקדם לפתרון שלה ואף לפרשנותה.
אולם, ה מחקריו של שרדינגר הביאו חוסן רב כדי להצדיק את האנרגיה של אטומים ואלקטרונים מתנות. לדוגמה, הרזולוציה של משוואת שרדינגר מאשרת את המודל האטומי של בוהר עבור אטום המימן ואטומים הידרוגנואידים אחרים (אלה שיש להם רק אלקטרון אחד). כמו שרדינגר, בוהר הגיע לרמות האנרגיה המותרות עבור אטום המימן.
עם זאת, המודל האטומי של בוהר אינו מסוגל להגיע לרמות אלקטרוניות עבור אטומים עם יותר מאלקטרון אחד, ובכך מדגים את החולשה העיקרית שלו. כאשר קיימים שני אלקטרונים, יש צורך לשקול את הדחייה האלקטרונית ביניהם, פרמטר שניתן להוסיף להבנה המתמטית שהציע שרדינגר.
נקודה חשובה נוספת במחקריו של שרדינגר היא התאמה של מושגים קוונטיים, כמו הדואליות של החלקיק, וכן מסלול מדויק של אלקטרון. ההגדרה של מסלול אטומי חשובה מאוד להבנת מבנה כל האטומים. א צפיפות הסתברות (ψ²) עוזרת לנו להבין כיצד אלקטרונים תופסים אורביטלים אטומיים באטומים פולילקטרונים, מביא מידע ספציפי יותר על האנרגיה של האלקטרון.
מאת סטפנו אראוחו נובאיס
מורה לכימיה
למד עוד על מבנה האטום והחלקיקים העיקריים שלו: פרוטונים, נויטרונים ואלקטרונים.
דע את התפתחות המודל האטומי בהיסטוריה.
לחצו ולמדו על המאפיינים העיקריים של המודל האטומי של רתרפורד ועל הניסוי שאיפשר את ניסוחו.
גלה מהם המאפיינים העיקריים, הבעיות ומאילו היבטים הוצע המודל האטומי של תומסון!
היכנסו ופגשו את אטום בוהר, שהיה מודל אטומי המבוסס על הנחות שתיארו בהצלחה את אטום המימן.