אוסמוסקופיה הוא בעלות משותפת (האחרים הם טונוסקופיה, אבוליוסקופיה ו קריוסקופיה) החוקרת את המופע של סְפִיגָה בין שני פתרונות בריכוזים שונים, אחד מהם מרוכז יותר מהשני.
הערה: תכונות קולגטיביות מתרחשות כאשר מוסר ממס לא נדיף.
כמו אוסמוסקופיה ללמוד אוסמוזה, זה חיוני לדעת מה זה התופעה הזו. לשם כך נשתמש בפתרונות להלן, המופרדים על ידי קרום חדיר למחצה:
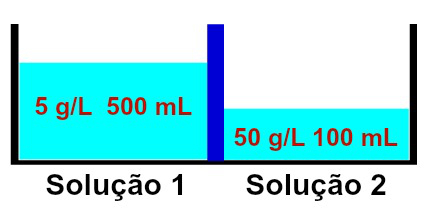
ייצוג פתרונות בעלי ריכוזים שונים
נצפה כי תמיסה 1 מכילה ריכוז של 5 גרם / ליטר ונפח של 500 מ"ל, בעוד ש- תמיסה 2 יש ריכוז של 50 גרם / ליטר ונפח של 100 מ"ל, מופרדים על ידי קרום למחצה. פתרון 2 מרוכז יותר מתמיסה 1 ולכן אוסמוזה חייבת להתרחש ביניהם.
אוסמוזה חייבת להתרחש בהכרח מתמיסה 1 לפתרון 2, מכיוון שפתרון 1 פחות מרוכז. במהלך התרחשות זו, חלק מהממס חוצה את הקרום החדיר למחצה, מה שהופך את נפח התמיסה 2 גדל ונפח התמיסה 1 יורד, עד ששני הפתרונות מתחילים להיות בעלי אותו ריכוז, כלומר איזוטוניה.

שינוי בגובה הפתרונות 1 ו -2 עקב התרחשות האוסמוזה
הערה: מדיה איזוטונית הם כאלה שריכוזם שווה.
על פי אוסמוסקופיה, אוסמוזה מתרחשת מכיוון שלחץ האדים המרבי של הממיס בתמיסה הפחות מרוכזת גדול מזה של הממיס בתמיסה המרוכזת יותר. כעת, אם אנו רוצים למנוע התרחשות של אוסמוזה, פשוט הפעילו לחץ על הפתרון המרוכז ביותר:
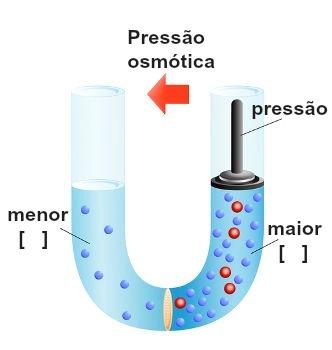
ייצוג ביצוע הלחץ על הפיתרון המרוכז ביותר
לחץ זה, המופעל על התמיסה המרוכזת ביותר לחסימת או אפילו הפיכת אוסמוזה, נקרא לחץ אוסמוטי ומיוצג על ידי הסמל π. זה צריך להיות ביחס ישר לריכוז הפתרון.
פרשנויות אפשריות ללחץ אוסמוטי
על פי מסקנות ה- אוסמוסקופיה, לכל תמיסה יש לחץ אוסמוטי, מכיוון שזה קשור לריכוז, מאפיין הקיים בכל תמיסה.
כאשר משווים מדיום אחד או פתרון אחד למשנהו, אנו יכולים להשתמש במונחים הבאים:
היפרטוני: כאשר מדיום אחד מציג לחץ אוסמוטי גדול מהשני;
היפוטוני: כאשר למדיום אחד לחץ אוסמוטי נמוך מזה של אחר;
איזוטוני: כאשר לשני המדיה או הפתרונות יש אותו לחץ אוסמוטי.
לפיכך, כאשר משווים את הלחץ האוסמוטי של שני פתרונות A ו- B, המיוצגים על ידי πה ו- πבאנו יכולים לומר כי:
אם הלחץ האוסמוטי של A ו- B שווה, האמצעים או הפתרונות יהיו איזוטוניים:
πה = πב
אם הלחץ האוסמוטי של A גדול מהלחץ האוסמוטי של B, בינוני A יהיה היפרטוני ביחס ל- B:
πה> πב
אם הלחץ האוסמוטי של B נמוך מהלחץ האוסמוטי של A, בינוני B יהיה היפוטוני ביחס ל- B:
πב< πה
פורמולה לחישוב לחץ אוסמוטי
π = M.R.T
בנוסחה זו:
π = הוא הלחץ האוסמוטי
M = הוא ה ריכוז במול / ליטר
R = הוא קבוע הגז הכללי (0.082 ללחץ באטמוס; 62.3 ללחץ במ"מ כספית)
T = טמפרטורה בקלווין
מכיוון שלריכוז במול / ליטר יש נוסחה מסוימת, כמוצג להלן:
M = M1
M1.V
אנו יכולים להחליף אותו בנוסחת הלחץ האוסמוטי:
π = M1.R.T
M1.V
הערה: אם המומס הקיים בתמיסה הוא יוני, עלינו להשתמש ב- גורם התיקון של Van't Hoff (ט) בביטוי חישוב הלחץ האוסמוטי:
π = M.R.T.i
דוגמא לחישוב לחץ אוסמוטי
דוגמא: (UF-PA) תמיסה המכילה 2 מ"ג של אנטיביוטיקה חדשה, ב- 10 מ"ל מים, בטמפרטורה של 25 מעלות צלזיוס, מייצרת לחץ אוסמוטי של 0.298 מ"מ כספית. אז המסה המולקולרית של אנטיביוטיקה זו היא בערך:
א) 3000
ב) 5200
ג) 7500
ד) 12500
ה) 15300
הנתונים שמסרו התרגיל היו:
π = 0.298 מ"מ כספית
T = 25 אוC או 298 K (לאחר הוספת עם 273)
M1 = 2 מ"ג או 0.002 גרם (לאחר חלוקה ב- 1000)
V = 10 מ"ל או 0.01 ליטר (לאחר חלוקה ב- 1000)
R = 62.3 מ"מ כספית
כדי לפתור תרגיל זה, פשוט החל את הנתונים הזמינים בביטוי לחישוב הלחץ האוסמוטי, כדלקמן:
π = M1.R.T
M1.V
0,298 = 0,002.62,3.298
M1.0,01
0.298.M1.0,01 = 37,1308
0.00298.M1 = 37,1308
M1 = 37,1308
0,00298
M1 = 12460 u
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-osmoscopia.htm

