ה איזומריזם זוהי תופעה הנצפית כאשר תרכובות שונות נוצרות על ידי כמויות שוות של אותם סוגי אטומים.
לכן, אנו יכולים למצוא חומרים כימיים עם אותה נוסחה מולקולרית ונוסחאות מבניות שונות או סידורים מרחביים.
תופעה זו נצפית באופן נרחב בכימיה אורגנית, החוקרת תרכובות פחמן. מכיוון שכל אטום של יסוד זה יכול ליצור 4 קשרים כימיים, ניתן לצפות בשילובים שונים.
מכיוון שהשינוי בסידור האטומים מוליד חומרים חדשים, כתוצאה מכך, יש להם תכונות פיזיקליות וכימיות שונות.
כאשר אנו אומרים אילו תרכובות הן איזומרים פירושו שיש להם חלקים שווים, שכן המילה היא שילוב של שני מונחים ממקור יווני: איזוס, פירושו "באמת", ו סְתָם, שזה "חלקים".
שתי הקבוצות העיקריות של איזומריזם הן מישור וחלל (סטריאואיזומריזם).
ה איזומריזם שטוח ניתן להמחיש אותו באמצעות נוסחת המבנה השטוחה של התרכובות ויש לו חמש מחלקות: מיקום, פונקציה, שרשרת, פיצוי וטאוטומריה.
ה איזומריזם בחלל הוא נצפה על ידי כיוון התרכובות והוא מחולק לגיאומטרי (cis-trans) ואופטי.
המושג איזומריזם הוצג בשנת 1830 על ידי המדען השוודי יעקב ברזליוס.
דוגמאות לאיזומרים
ה איזומריזם של שרשרת זה מתרחש כאשר אותה קבוצה של אטומים מתחברת ליצירת מבנים של אותה קבוצה פונקציונלית, אך עם שרשראות שונות.
דוגמה: הנוסחה המולקולרית C4ח10 של פחמימן יכול להיות ישר או מסועף.

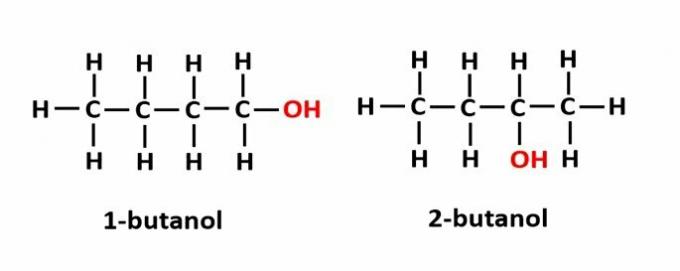
ה עמדת איזומריזם מתרחש כאשר תרכובות נוצרות על ידי אותן קבוצות פונקציונליות, אך הן נמצאות במיקומים שונים בשרשרת.
דוגמה: הנוסחה המולקולרית C4ח9OH מתאים לשני סוגי אלכוהול.
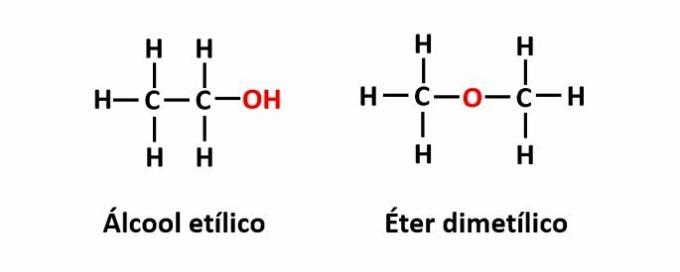
ה פונקציה איזומריזם מתרחש כאשר אותה נוסחה מולקולרית מתאימה לשתי תרכובות בעלות קבוצות פונקציונליות שונות.
דוגמה: הנוסחה המולקולרית C2ח6O מתאים לשני איזומרים בעלי פונקציות האלכוהול (-OH) והאתר (-O-).
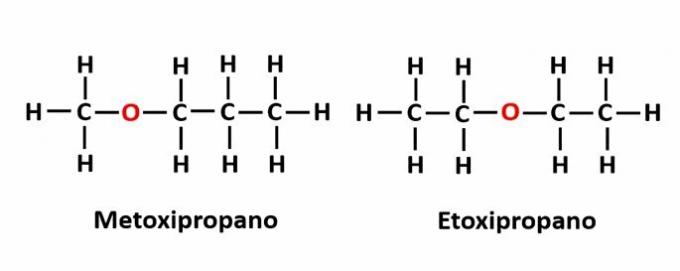
ה איזומריזם פיצוי זה מתרחש כאשר יש הטרואטום בשרשרת והוא תופס עמדות שונות. זהו מקרה מסוים של איזומריזם עמדה.
דוגמה: הנוסחה המולקולרית C4ח10הסמל מציין את נוכחותו של אטום חמצן בשרשרת, אך מיקומו יכול להשתנות וליצור תרכובות שונות.
ה איזומריזם דינמי, הנקראת גם טאוטומריה, מתרחשת כאשר שתי תרכובות בעלות פונקציות שונות נמצאות באותו פתרון בשיווי משקל דינמי. זהו מקרה מסוים של איזומריזם פונקציונלי.
דוגמה: הנוסחה המולקולרית C2ח4O מתאים לתרכובות עם פונקציות אלדהיד ואנול.
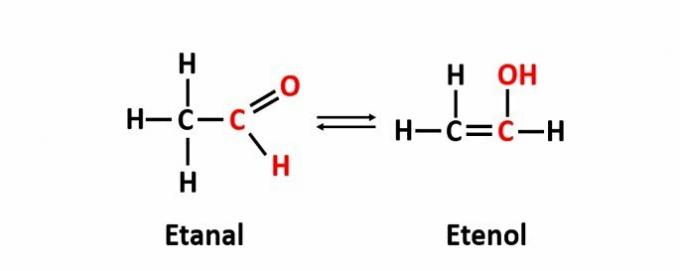
למידע נוסף על איזומריזם שטוח.
ה איזומריזם גיאומטרי, הנקרא גם איזומריה ציס-טרנס, מתרחשת כאשר נוכחות של קשר כפול או מבנה מחזורי גורם לליגנדים שווים להיות באותו צד של המישור (cis) או בצדדים מנוגדים (עָבָר).
דוגמה: אטומי הכלור בתרכובות של נוסחה מולקולרית C2ח2Cl2 ייתכן שיש להם שני מבנים מרחביים.
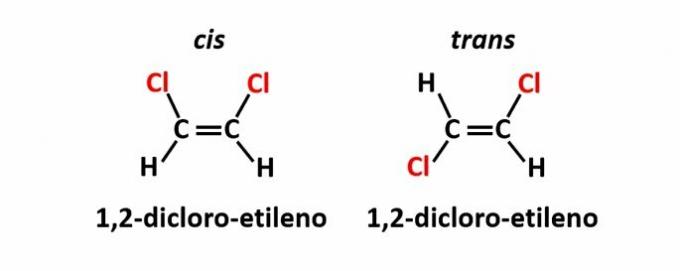
ה איזומריזם אופטי מתרחש כאשר, בעת הסטת האור המקוטב הנפלט על המבנה, התרכובות מצליחות להסיט את האלומה זוהר משמאל, אם הוא איזומר מסתובב לכיוון (l), או מימין, כאשר הוא איזומר מסתובב ידו. (ד).
דוגמה: סוג זה של איזומריזם מתרחש עם חומצת חלב. שימו לב להלן שהתמונות הספקטרליות של האיזומרים אינן חופפות, ולכן הן נקראות אננטיומרים.
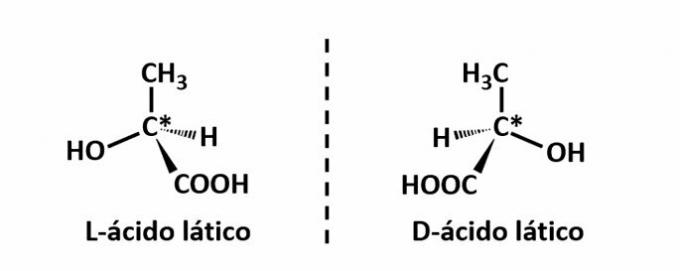
הסמל C* מציין את נוכחותו של פחמן כיראלי במבנה זה, כלומר אטום פחמן בעל 4 קישורים שונים.
למד עוד על איזומריזם עם התוכן:
- סוגי איזומריזם
- איזומר חלל
- איזומר גיאומטרי
- איזומר אופטי
- תרגילים על איזומריזם מישור