המולקולות של החומרים אינן כולן ישרות, כאילו היו במישור אחד. אחרי הכל, הם מפוזרים בחלל והאטומים שלהם מקבלים סידורים או סידורים שונים. לפיכך, קיימות צורות גיאומטריות שונות למולקולות של כל סוג של חומר.
אחת הדרכים הפשוטות ביותר לקבוע את הגיאומטריה של מולקולה מבוססת על התיאוריה של דחייה של זוגות אלקטרונים של מעטפת ערכיות (RPECV). לפי תיאוריה זו, זוגות האלקטרונים של האטום המרכזי מתפקדים כ עננים אלקטרוניים שדוחים אחד את השני. בדרך זו, הם מכוונים רחוק ככל האפשר אחד מהשני. גיאומטריה מולקולרית תהיה תלויה במספר הזוגות האלקטרוניים סביב האטום המרכזי.
הענן האלקטרוני הזה יכול להיות מורכב מאלקטרונים המשתתפים בקשרים (יחיד, כפול או משולש) וגם שאינם משתתפים. אז יש לנו:
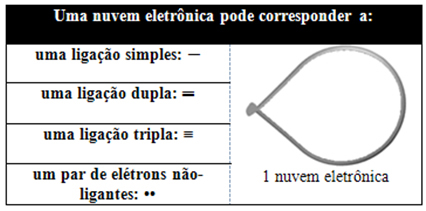
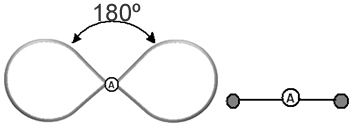
זה עוזר לחשוב על הענן הזה כעל בלון או בלונים קשורים, כשהאטום המרכזי במרכזם. לדוגמה, במולקולה שיש לה רק שני ענני אלקטרונים מסביב לאטום המרכזי, הגדול יותר המרחק האפשרי ביניהם הוא זווית של 180º, וכתוצאה מכך, הגיאומטריה של המולקולה תהיה ליניארי.
לכן, נוכל להסיק מה תהיה הגיאומטריה המולקולרית של רוב המולקולות אם ניקח בחשבון את מספר האטומים במולקולות, והקשרים שהאטום המרכזי יוצר, בודקים אם יש לו זוגות של אלקטרונים.
ראה את הדוגמאות שלהלן:
- מולקולות עם 2 אטומים: תמיד יהיו ליניארי
לדוגמה:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
אל תפסיק עכשיו... יש עוד אחרי הפרסום ;)
- מולקולת 3 אטומים: זוויתי או משולש
אם האטום המרכזי יש להם זוג אלקטרונים לא מחייבים הגיאומטריה תהיה זוויתי, כמו במקרה של מולקולת SO2:
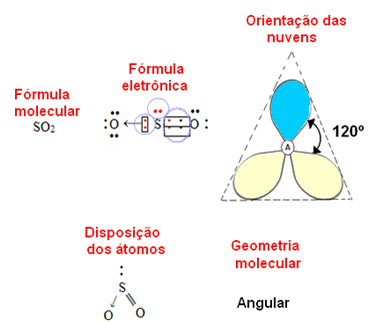
ראה את ענן האלקטרונים הכחול כמייצג זוגות אלקטרונים שאינם משתתפים בקשרים, והצהוב הוא זוגות אלקטרונים המשתתפים בקשרים.
- מולקולת 4 אטומים: מישור טריגונל (או משולש) או פירמידה (או פירמידה משולשת)
אם לאטום המרכזי אין זוג אלקטרונים לא מזווג (לא מקשר), הגיאומטריה המולקולרית היא טריגונלית שטוחה (או משולשת). תראה את הדוגמה של BF3:

אם לאטום יש זוגות אלקטרונים לא מחייבים, הגיאומטריה של המולקולה תהיה פירמידה (או פירמידה טריגונלית), כמו במקרה של אמוניה:

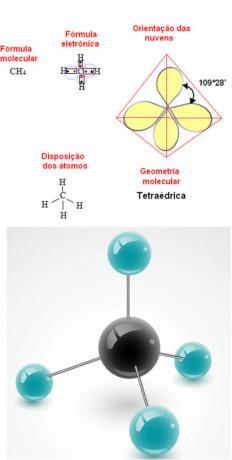
- מולקולת 5 אטומים: טטרהדרלית
דוגמה לגיאומטריית מתאן:
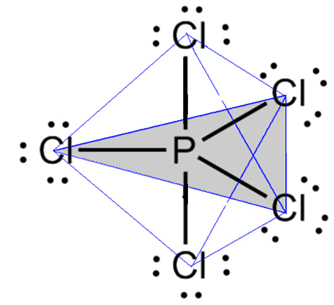
- מולקולה עם 6 אטומים: דו-פירמידה משולשת או פירמידה משולשת.
דוגמה לכך היא זרחן פנטכלוריד (PCl5), שיש לו כמה קשרים בין זרחן לכלור בזווית של 90º ואחרים של 120º, ויוצרים דו-פירמידה עם בסיס משולש:
- מולקולת 7 אטומים: אוקטהדרלית
דוגמה: גופרית הקספלואוריד (SF6), שזוויותיו הן 90º.

מאת ג'ניפר פוגאסה
בוגר לימודי כימיה
האם תרצה להתייחס לטקסט זה בעבודה בית ספרית או אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "קביעת הגיאומטריה של מולקולות"; בית ספר ברזיל. זמין ב: https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm. נגיש ב-27 ביולי 2021.