ה אנטלפיה היא פונקציה תרמודינמית שבאמצעותה מחשב את החום הכרוך בתהליכים איזובארייםכלומר, המוחזקים בלחץ מתמיד. התפתחותו התרחשה זמן קצר לאחר נפילת התיאוריה הקלורית, עם התקדמות תֶרמוֹדִינָמִיקָה בין השנים 1840 ו-1850.
האנטלפיה, עבור ה מהאומיקה, אין לו הרבה משמעות אם הוא עובד כערך מוחלט ומבודד, אבל יש לו כאשר שוקלים את שינוי ערכו בתהליך כימי. ישנן מספר דרכים לחשב את וריאציות האנטלפיה של תהליך, העיקריות שבהן הן באמצעות האנרגיות של היווצרות, הקישור וגם על ידי שםהיי מהס.
קראו גם: מהי אנרגיה חופשית של גיבס?
סיכום אנתלפיה
אנתלפיה היא כלי תרמודינמי לחישוב החום הכרוך בתהליכים המתרחשים בלחץ קבוע.
זה הוגדר על ידי הפיזיקאי האמריקאי ג'וזיה וו. גיבס, בהקשר של נפילת התיאוריה הקלורית.
בכימיה, אנו משתמשים תמיד בשינוי האנתלפיה, המיוצג כ-ΔH.
תגובות כימיות שסופגות חום נקראות אנדותרמיות ובעלות ΔH > 0.
תגובות כימיות המשחררות חום נקראות אקסותרמיות ובעלות ΔH < 0.
שיעור וידאו על אנטלפיה
מהי אנטלפיה?
האנטלפיה, המיוצגת תמיד על ידי H, הייתה בתחילה הוגדר על ידי הפיזיקאי האמריקאי ג'וזיה וילארד גיבס, שאותו כינה פונקציית החום בלחץ קבוע, שכן, כדבריו:
"[...] הירידה בתפקוד מייצגת, בכל המקרים שבהם הלחץ אינו משתנה, את החום שמוותר על ידי המערכת."
מעבודתו של גיבס, אם כן, אנו יכולים להבין את האנטלפיה כפונקציה תרמודינמית שלה וריאציה שווה מספרית לכמות החום המוחלפת במערכת, ל לַחַץ קָבוּעַ. זה אומר שבתהליכים איזובאריים (כמו רוב התהליכים הכימיים), ידיעה לחשב את הווריאציה של פונקציית האנטלפיה, לאחר מכן ניתן לדעת את ערך החום המוחלף בין מערכת ו שְׁכוּנָה.

מתאם כזה עם חום גורם תלמידים רבים חושבים בטעות שאנתלפיה היא שם נרדף ל חוֹם או משהו כמו תכולת אנרגיה, תכולת חום, חום משוחרר וחום נספג וכדומה.
האנטלפיה התעוררה בהקשר של קריסת התיאוריה הקלורית, שהתייחסה לחום כאל חומר חומרי בלתי ניתן לביצוע, שהועבר מגופים חמים יותר לגופים קרים יותר. לפיכך, היה צורך בכלי חדש לחישוב חום. הפתרון, אם כן, היה להשתמש בכמויות שכבר הגדירו משוואות תרמודינמיות, כמו אנטלפיה.
קראו גם: כיצד לחשב את שינוי האנתלפיה של הפתרון?
וריאציה של אנתלפיה
מכיוון שאנתלפיה היא כלי המשמש לחישוב החום המוחלף בתהליך כימי, אין זה הגיוני להשתמש בו כמספר מוחלט ומבודד, אבל בהתחשב בווריאציה שלה, כלומר, בפועל, עלינו להעריך רק עד כמה, מבחינה מספרית, השתנתה האנטלפיה במהלך התהליך הכימי, שכן התרמודינמיקה מבטיחה לנו שהיא וריאציה היא שווה מספרית לחום המשתחרר או נספג בתהליך.
באופן קפדני, אנו יכולים להגדיר את וריאציית האנטלפיה כ:
ΔH = Hסופי - חהתחלתי
כמו בתהליכים כימיים, השלב הסופי יכול להיחשב כמוצרים והשלב הראשוני יכול להיחשב כריאגנטים. מקובל גם לראות את ההגדרה של וריאציה באנטלפיה כ:
ΔH = Hמוצרים - חריאגנטים
מנקודת מבט מעשית ופרשנית, אם השינוי באנתלפיה חיובי (ΔH> 0), אנו אומרים שהתגובה הכימית היא אנדותרמיכלומר יש ספיגת חום לאורך כל התהליך. כְּבָר אם השינוי באנטלפיה שלילי (ΔH< 0), אנו אומרים שהתגובה הכימית היא אקסותרמיכלומר, חום משתחרר לאורך כל התהליך.
וריאציה של האנתלפיה, במקרים רבים, נצפית בגרפים, כפי שמוצג בדוגמאות הבאות.
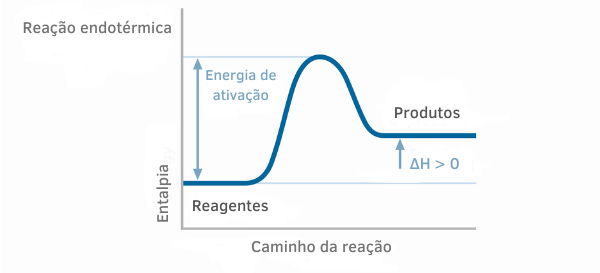
דוגמה 1:
תרשים תגובה אנדותרמית
בגרפי האנטלפיה לתגובות אנדותרמיות, ניתן לראות שכמות האנטלפיה של התוצרים גדולה מזו של המגיבים, מה שמעיד על כך שהשונות לאורך התגובה חיובית. לפיכך, אם ΔH > 0, אנו יכולים לומר שהתהליך הכימי התרחש עם ספיגת חום.
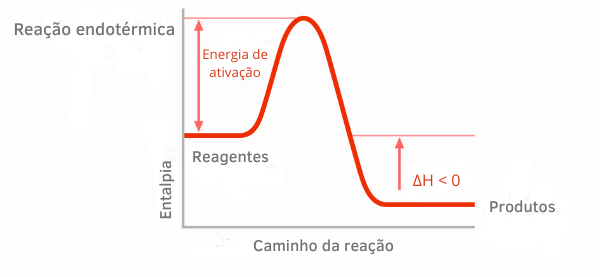
דוגמה 2:
תרשים תגובה אקסותרמית:
בגרפי האנטלפיה לתגובות אקסותרמיות, ניתן לראות שכמות האנטלפיה של התוצרים קטנה מזו של המגיבים, מה שמעיד על כך שהשונות לאורך התגובה היא שלילית. לפיכך, בהיותו ΔH < 0, אנו יכולים לומר שהתהליך הכימי התרחש עם שחרור החום.
קרא עוד על סיווגים אלה של תגובות כימיות בטקסט: לתהליכים אנדותרמיים ואקסותרמיים.
סוגי אנטלפיה
אנטלפיה של היווצרות
ה אנטלפיה של היווצרות é מְחוֹשָׁב מבוסס על ה היווצרות תגובות כימיות, שהן תגובות שבהן נוצרת שומה אחת של חומרים מורכבים מהחומרים הפשוטים היציבים ביותר שלהם בטמפרטורת החדר ו-1 אטמוספירה של לחץ.
ח2(ז) + ½ O2 (ז) → H2O (l) H°ו = -286 קילו ג'ל/מול
היתרון הגדול של האנטלפיה של היווצרות הוא שלחומרים פשוטים שהם יציבים יותר בטמפרטורת החדר ו-1 אטמוספירה של לחץ יש אנתלפיה מוסכמת לאפס. זה לא אומר שהם למעשה אפס, אבל, לשם פישוט וסיווג טוב יותר, מתייחסים אליהם כך.
להיות ח = Hמוצרים - חריאגנטים, אם ניקח בחשבון, אז, כי Hריאגנטים = 0, אנו יכולים לומר שהערך הנצפה של ΔH קשור רק לתוצרים, שבמקרים אלה הם תמיד שומה אחת של החומר המורכב. לכן, אנו שולחים ערך זה כווריאציית האנתלפיה הסטנדרטית של היווצרות מים, המיוצגת על ידי ΔH°ו.
במתודולוגיה זו היו וריאציות של מספר חומרים אנתלפיה סטנדרטית טבלאות היווצרות, כפי שאנו יכולים לראות להלן.
חומר |
אנטלפיה של היווצרות (ΔH°ו) ב-kJ/mol |
שיתוף2 (ז) |
-393,4 |
CaO(s) |
-634,9 |
HI(g) |
+25,9 |
לא (ז) |
+90,1 |
אנטלפיה מחייבת
האנטלפיה הקישורית משמשת להצביע על כמות האנרגיה הכרוכה בקרע או היווצרות של שומה נתונה. קשר כימי.
מובן ש, כדי לשבור קשר כימי, יש צורך לספוג חום, כך שהאטומים המחוברים מגדילים את שלהם אנרגיה פנימית וכתוצאה מכך, להגדיל את האנרגיה הקינטית שלך. עם גדול יותר אנרגיה קינטית, האטומים רוטטים בצורה אינטנסיבית יותר, מה שגורם לקשרים להישבר. לפיכך, כל שבירת קשר היא תהליך אנדותרמי.
אחרת, כדי ליצור קשר כימי, האטומים מאבדים את חופש התנועה וצריכים להפחית את מידת התנועה שלהם, ולהפחית את האנרגיה הקינטית שלהם. לאחר מכן משתחררת האנרגיה הפנויה בצורה של חום. לכן, כל יצירת קשרים היא תהליך אקסותרמי.
הטבלה שלהלן מציגה ערכים של האנרגיות הקשורות לכל קשר כימי.
חיבור |
אנרגיית קישור (kJ/mol) |
ג-ה |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
לא |
943,8 |
שימו לב שאין סימנים בערכים, מכיוון שהם נמצאים במודולוס. הסיבה לכך היא שהאות חייב להיות מוקצה על ידך בהתאם לשאלה אם הקישור נשבר או נוצר.
אנטלפיה בעירה
ה אנטלפיה בעירה משמש לציין את כמות החום המשתחררת בשריפה של שומה אחת של חומר. יש לציין שכל תגובת בעירה היא אקסותרמית, שכן כל שריפה משחררת חום.
CH4 (ז) + 2 O2 (ז) → CO2 (ז) + 2 H2ה- ΔH°Ç = -889.5 קילו ג'ל/מול
הטבלה שלהלן מציגה ערכי אנטלפיה של בעירה עבור כמה חומרים כימיים.
חומר |
אנטלפיה בעירה (ΔH°Ç) ב-kJ/mol |
אתנול - C2ח5הו (1) |
-1368 |
בנזן - סי6ח6 (1) |
-3268 |
אוקטן - C8ח18 (1) |
-5471 |
גלוקוז - C6ח12O6 (ים) |
-2808 |
אנתלפיה של שינוי מצב פיזי
כל שינוי במצב הפיזי כרוך בחילופי חום. לכן, ה אנטלפיה של שינוי מצב פיזי משמש לציין את כמות החום המעורבת בתהליכי שינוי מצב פיזי.
לדוגמה, יש לנו אידוי מים:
ח2O (1) → H2O (g) ΔH = +44 kJ/mol
בהתכה של מים, יש לנו:
ח2O(s) → H2O (l) ΔH = +7.3 kJ/mol
ערכי האנתלפיה הם סימטריים לתהליכים הפוכים, כלומר, למשל, שינוי האנתלפיה בהנזלת המים הוא -44 קילו-ג'יי/מול, בעוד שבהתמצקותם הוא שווה ל-7.3 קילו-ג'יי-מול.
קראו גם: מהי אנטרופיה?
פתרו תרגילים על אנתלפיה
שאלה 1 - (UERJ 2018) היכולת המזהמת של פחמימן המשמש כדלק נקבעת על ידי היחס בין האנרגיה המשתחררת לכמות ה-CO2 נוצר בעירה מלאה שלו. ככל שהיחס גבוה יותר, היכולת המזהמת נמוכה יותר. הטבלה שלהלן מציגה את האנטלפיה הסטנדרטית של בעירה של ארבעה פחמימנים.

מהטבלה, הפחמימן בעל יכולת המזהמים הנמוכה ביותר הוא:
אוֹקטָן
הקסאן
בֶּנזִין
פנטן
פתרון הבעיה
חלופה D
השאלה מצביעה על כך שהיכולת המזהמת מוגדרת כיחס (מנה) בין האנרגיה המשתחררת לכמות ה-CO2 נוצר בעירה מלאה שלו. גדול יותר סיבה, ככל שהיכולת המזהמת נמוכה יותר, כלומר משתחררת יותר אנרגיה למול CO2 נוצר.
תגובות הבעירה המלאות של פחמימנים המצוטטים הם:
אוֹקטָן: Ç8ח18 +25/2 O2 → 8 CO2 + 9 שעות2הסיבה: 5440/8 = 680
הקסאן: Ç6ח14 +19/2 O2 → 6 CO2 + 7 שעות2הסיבה: 4140/6 = 690
בֶּנזִין: Ç6ח6 + 15/2 O2 → 6 CO2 + 3 H2הסיבה: 3270/6 = 545
פנטן: Ç5ח12 + 8 O2 → 5 CO2 + 6 H2הסיבה: 3510/5 = 702
לפיכך, אנו יכולים להסיק כי פנטאן הוא הפחמימן בעל יכולת המזהם הנמוכה ביותר.
שאלה 2 - (אנם 2015) השימוש בשאריות היער הופך לאטרקטיבי יותר מדי יום, מכיוון שהם מקור אנרגיה מתחדש. הדמות מייצגת שריפת שמן ביו המופק מפסולת עץ, כאשר ΔH1 שינוי האנטלפיה כתוצאה משריפת 1 גרם מהביו-שמן הזה, וכתוצאה מכך פחמן דו חמצני ומים נוזליים, ו- ΔH2 שינוי האנטלפיה הכרוך בהמרה של 1 גרם מים במצב גז למצב נוזלי.

וריאציה של האנתלפיה, ב-kJ, לשריפת 5 גרם של ביו-שמן זה, וכתוצאה מכך CO2 (גזי) ו-H2(הגזי) הוא:
א) -106
ב) -94
ג) -82
ד) -21.2
ה) -16.4
פתרון הבעיה
חלופה C
מהגרף המוצג, יש לנו ΔH1 כמו וריאציה של האנתלפיה של שריפת שמן ביו המייצר CO2 (ז) וח2O (1) ו- ΔH2 כשינוי האנטלפיה של התנזלות מים, מאז ה-CO2 נשאר גזי ורק המצב הפיזי של ה מים שינויים (מגז לנוזל).
התרגיל מבקש את שינוי האנטלפיה של שריפת 5 גרם של ביו-שמן, וכתוצאה מכך CO2 (גזי) ו-H2O (גזי). מהתרשים, ניתן להגדיר שינוי באנתלפיה זה כ- ΔH = ΔH1 – ח2. לפיכך, הערך של ΔH יהיה שווה ל-16.4 kJ/g. וריאציה זו, כפי שאנו יכולים לראות ביחידה, היא עבור כל גרם של ביו-שמן. עבור 5 גרם, אנחנו חייבים לעשות את פּרוֹפּוֹרצִיָה:
1 גרם של ביו-שמן -16.4 קילו-ג'יי
5 גרם של ביו-שמן x
1. x = 5. (-16,4)
x = -82 קילו-ג'יי
לאחר מכן נוכל לסמן חלופה C.
מאת Stéfano Araújo Novais
מורה לכימיה


