תכונות קולגטיביות כוללות מחקרים בנושא תכונות פיזיקליות של פתרונות, ליתר דיוק של ממס בנוכחות מומס.
למרות שלא למיטב ידיעתנו, נעשה שימוש נרחב בתכונות הקולגיטיביות בתהליכים תעשייתיים ואף במצבים יומיומיים שונים.
קשורים למאפיינים אלה הם קבועים פיזיים, למשל, טמפרטורת הרתיחה או ההיתוך של חומרים מסוימים.
כדוגמה, אנו יכולים לצטט את תהליך תעשיית הרכב, כגון הוספת תוספים לרדיאטורים לרכב. זה מסביר מדוע במקומות קרים יותר המים ברדיאטור אינם קופאים.
תהליכים המבוצעים עם מזונות, כגון המלחת בשר או אפילו מזונות רוויים בסוכר, מונעים את הידרדרותם והתפשטותם של אורגניזמים.
בנוסף, התפלת מים (פינוי מלח) וכן פיזור מלח על שלג במקומות כאשר החורף קשה מאוד, מאשרים את החשיבות של הכרת ההשפעות הקולגטיביות פתרונות.
רוצה ללמוד עוד על מושגים הקשורים לתכונות קולגטיביות? קרא את המאמרים:
- מצבים פיזיים של מים
- נקודת התכה ונקודת רתיחה
- התפלת מים
- הפרדת תערובות
ממס וממיס
קודם כל, עלינו לשים לב למושגים של ממס וממיס, שני מרכיבי הפתרון:
- מֵמֵס: חומר שמתמוסס.
- מומס: חומר מומס.
כדוגמה, אנו יכולים לחשוב על תמיסה של מים עם מלח, כאשר מים מייצגים את הממס והמלח, המומס.
רוצים לדעת יותר? קרא גם מְסִיסוּת.
השפעות קולגטיביות: סוגי מאפיינים קולגטיביים
השפעות קולגטיביות קשורות לתופעות המופיעות עם הממיסים והממיסים של תמיסה, ומסווגות כ:
אפקט טונומטרי
טונוסקופיה, הנקראת גם טונומטריה, היא תופעה שנצפית כאשר ה ירידה בלחץ האדים המרבי של נוזל (מֵמֵס).
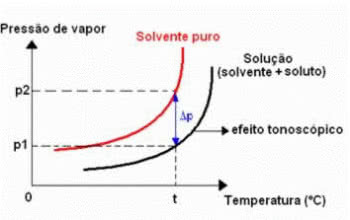
תרשים אפקטים טונומטריים
זה קורה באמצעות פירוק של מומס שאינו נדיף. לכן, המומס מקטין את יכולת האידוי של הממיס.
ניתן לחשב סוג זה של אפקט קולגטיבי על ידי הביטוי הבא:
Δפ = עמ '0 - פ
איפה,
Δפ: הורדה מוחלטת של לחץ האדים המרבי לתמיסה
פ0: לחץ אדים מרבי של נוזל טהור, בטמפרטורה t
פ: לחץ אדים מקסימלי של התמיסה, בטמפרטורה t
אפקט אמביומטרי
Ebullioscopy, המכונה גם ebulliometrics, היא תופעה שתורמת ל עלייה בשינוי הטמפרטורה של נוזל בתהליך הרתיחה.
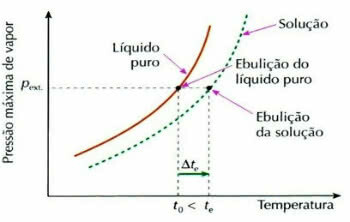
גרף אפקטים אמבולימטריים
זה קורה באמצעות פירוק של מומס שאינו נדיף, למשל, כאשר אנו מוסיפים סוכר למים העומדים לרתיחה, טמפרטורת הרתיחה של הנוזל עולה.
מה שנקרא אפקט ebulliometric (או ebullioscopic) מחושב על ידי הביטוי הבא:
tו = tו - t0
איפה,
tו: עלייה בטמפרטורת הרתיחה של התמיסה
tו: טמפרטורת הרתיחה הראשונית של התמיסה
t0: טמפרטורת רתיחה של נוזל טהור
אפקט קריומטרי
קריוסקופיה, הנקראת גם קריומטריה, היא תהליך בו ה ירידה בטמפרטורת הקפאהשל פיתרון.
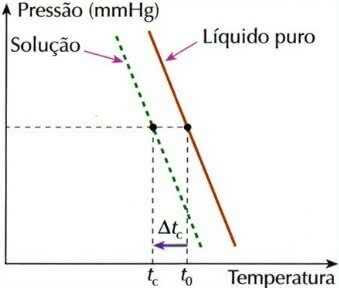
גרף אפקט קריומטרי
הסיבה לכך היא שכאשר מומס בלתי נדיף מומס בנוזל, טמפרטורת ההקפאה של הנוזל יורדת.
דוגמא לקריוסקופיה הם התוספים למניעת הקפאה המונחים ברדיאטורים לרכב במקומות בהם הטמפרטורה נמוכה מאוד. תהליך זה מונע הקפאת מים, ומסייע לחיים השימושיים של מנועי הרכב.
בנוסף, המלח הנמרח ברחובות במקומות בהם החורף קר מאוד, מונע הצטברות קרח בכבישים.
כדי לחשב את האפקט הקולגיטיבי הזה, משתמשים בנוסחה הבאה:
tç = t0 - tç
איפה,
tç: הורדת טמפרטורת ההקפאה של התמיסה
t0: טמפרטורת הקפאה של ממס טהור
tç: טמפרטורת הקפאה ראשונית של הממיס בתמיסה
בדוק ניסוי על נכס זה בכתובת: ניסויים בכימיה
חוק ראולט
מה שמכונה "חוק ראולט" הוצע על ידי הכימאי הצרפתי פרנסואה-מארי ראולט (1830-1901).
הוא בחן את ההשפעות הקולגטיביות (טונומטריה, אבולומטרית וקריומטרית), ועזר במחקרי המונים המולקולריים של חומרים כימיים.
על ידי חקר התופעות הקשורות להתמוססות ולהרתחת מים, הוא הגיע למסקנה שכאשר ממיסים שומה אחת של כל מומס שאינו נדיף ולא יוני בכמ"ג אחד של ממס, תמיד יש לך אותו טונומטרי, אבולומטרי או קריומטרי.
לפיכך, חוק ראולט יכול לבוא לידי ביטוי באופן הבא:
“בתמיסה מומסת לא נדיפה ולא יונית, ההשפעה הקולגטיבית היא פרופורציונאלית למולליות של התמיסה.”.
זה יכול לבוא לידי ביטוי כדלקמן:
פפִּתָרוֹן = xמֵמֵס. פממס טהור
קרא גם על ה- מספר מול ומסה טוחנת.
אוסומטריה
Osmometry הוא סוג של מאפיין קולגטיבי שקשור אליו לחץ אוסמוטי של פתרונות.
זכרו כי אוסמוזה היא תהליך פיזיקוכימי הכרוך במעבר מים ממדיום פחות מרוכז (היפוטוני) למדיום מרוכז יותר (היפרטוני).
זה מתרחש דרך קרום חדיר למחצה, שמאפשר רק מעבר מים.
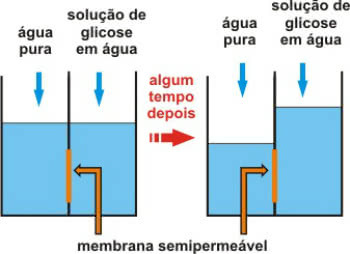
פעולת קרום חדירה למחצה לאחר זמן מה
השיחה לחץ אוסמוטי הלחץ הוא שמאפשר למים לנוע. במילים אחרות, זהו הלחץ המופעל על התמיסה, המונע את דילולו על ידי העברת הממיס הטהור דרך הקרום החדיר למחצה.
לכן, אוסומומטריה היא מחקר ומדידה של לחץ אוסמוטי בתמיסות.
שימו לב שבטכניקת התפלת המים (פינוי מלח) התהליך שנקרא אוסמוזה הפוכה.
קרא עוד אודות סְפִיגָה.
חוקי אוסומטריה
הפיזיקאי והכימאי ההולנדי יעקובוס הנריקוס ואן הוף (1852-1911) היה אחראי להנחלת שני חוקים הקשורים לאוסומומטריה.
החוק הראשון יכול לבוא לידי ביטוי כדלקמן:
“בטמפרטורה קבועה, הלחץ האוסמוטי פרופורציונלי ישירות לטוחנות התמיסה.”
בחוק השני שהוצג על ידו יש לנו את ההצהרה הבאה:
“במצב טוחנות קבוע, הלחץ האוסמוטי הוא ביחס ישר לטמפרטורה המוחלטת של התמיסה.”
לכן, כדי לחשב את הלחץ האוסמוטי של תמיסות מולקולריות ומדוללות, משתמשים בנוסחה:
π = MRT
להיות,
π: פתרון לחץ אוסמוטי (כספומט)
M: טוחנות תמיסה (mol / L)
ר: קבוע אוניברסלי של גזים מושלמים = 0.082 atm. L / mol. ק
ט: הטמפרטורה המוחלטת של התמיסה (K)
קרא גם מולאריות.
תרגילי בחינת כניסה עם משוב
1. בהשוואה בין שתי מחבתות, בו זמנית על שני מבערים זהים על אותו תנור, נצפה כי הלחץ של גזים במים רותחים בסיר לחץ סגור גדול יותר מזה שבמים רותחים בסיר לחץ לִפְתוֹחַ.
במצב זה, ואם הם מכילים כמויות זהות בדיוק של כל המרכיבים, אנו יכולים לקבוע כי בהשוואה למה שקורה במחבת הפתוחה, זמן הבישול בסיר הלחץ סגור יהיה:
א) נמוך יותר, מכיוון שטמפרטורת הרתיחה תהיה נמוכה יותר.
ב) נמוך יותר, מכיוון שטמפרטורת הרתיחה תהיה גבוהה יותר.
ג) קטנים יותר, מכיוון שטמפרטורת הרתיחה אינה משתנה עם הלחץ.
ד) שווה, מכיוון שטמפרטורת הרתיחה אינה תלויה בלחץ.
ה) גבוה יותר, שכן הלחץ יהיה גבוה יותר.
חלופה ב
2. (UFRN) במקומות חורפיים קשים נהוג להוסיף כמות מסוימת של אתילן גליקול למים ברדיאטורים לרכב. השימוש בתמיסה במקום במים כנוזל קירור הוא מכיוון שבתמיסה יש:
א) חום נמוך יותר של היתוך.
ב) נקודת הקפאה נמוכה יותר.
ג) נקודת קפיאה גבוהה יותר.
ד) חום גבוה יותר של היתוך.
חלופה ב
3. (Vunesp) אחת הדרכים לרפא פצעים, על פי האמונה הרווחת, היא לשים עליהם סוכר או אבקת קפה. המאפיין הקולגטיבי המסביר בצורה הטובה ביותר את הסרת הנוזל על ידי ההליך המתואר, המעדיף ריפוי, נחקר על ידי:
א) אוסמומטריה.
ב) קריוסקופיה.
ג) אנדוסקופיה.
ד) טונוסקופיה.
ה) ebulliometrics.
חלופי ל
4. (UFMG) במקפיא, יש חמש דרכים המכילות נוזלים שונים, להכנת קרח וארטיקים לימון. אם התבניות מונחות במקפיא במקביל והן בתחילה באותה טמפרטורה, התבנית המכילה 500 מ"ל של: תוקפא תחילה
א) מים טהורים.
ב) תמיסה, במים, המכילה 50 מ"ל מיץ לימון.
ג) תמיסה במים המכילה 100 מ"ל מיץ לימון.
ד) תמיסה במים המכילה 50 מ"ל מיץ לימון ו- 50 גרם סוכר.
ה) תמיסה, במים, המכילה 100 מ"ל מיץ לימון ו- 50 גרם סוכר.
חלופי ל
5. (Cesgranrio-RJ) נקבעת נקודת ההיתוך של חומר x, ומצאה ערך נמוך מהטבלה עבור חומר זה. זה יכול להיות ש:
א) כמות החומר ששימשה לקביעה הייתה פחותה מהנדרש.
ב) כמות החומר ששימשה לקביעה הייתה גדולה מהנדרש.
ג) חלק מהחומר לא נמס.
ד) החומר מכיל זיהומים.
ה) החומר טהור ב 100%.
חֲלוּפָה