ה הידרוליזת מלח בין חומצות חזקות לבסיסים זה קורה כאשר הקטיון במלח אינו מתקשר עם האניון במים, והאניון במלח אינו מתקשר עם הקטיון במים. הידרוליזה בין קטיונים לאניונים של מלח ומים מתרחשת רק כאשר המוצר שנוצר הוא חומצה חלשה, בסיס חלש או שניהם. הבן את הידרוליזת המלח בין חומצות חזקות לבסיסים חזקים שלב אחר שלב:
א) שלב 1: יינון מים
מים הם חומר שיש לו יכולת לסבול אוטומציהכלומר, הוא מייצר קטיון הידרוניום (H+) ואניון הידרוקסיד (OH-) ממבנהו.
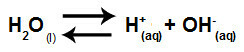
משוואה המייצגת יינון עצמי של מים
ב) שלב 2: דיסוציאציה של מלח
כאשר מוסיפים מלח למים, הוא עובר את תהליך הניתוק. מכיוון שמלח הוא תרכובת יונית, במים, הקטיונים והאניונים שלו משתחררים למדיום, כמו במשוואה המוצגת להלן:
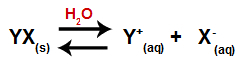
משוואה המייצגת את הניתוק של כל מלח
ג) שלב 3: הידרוליזת מלח של חומצות ובסיסים חזקים
לחומצה חזקה: כאשר האניון של המלח בשילוב עם ה- H+ של מים ליצירת HCl, HBr, HI או חומצה אחרת שבה חיסור מספר החמצן במספר מימנים שווה או גדול מ -2, יהיה לנו חומצה חזקה. לכן השילוב בין היונים שהוזכרו אינו מתרחש.
לבסיס חזק: כאשר הקטיון של המלח השייך למשפחות IA (מתכות אלקליות) או IIA (מתכות אדמה אלקליין שאינן מגנזיום) משולב עם OH
- של מים, זה יהווה א בסיס חזק. לכן השילוב בין היונים שהוזכרו אינו מתרחש.
כשיוני מלח אינם מתקשרים עם יוני מים, יש לנו את המשוואה הבאה:
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
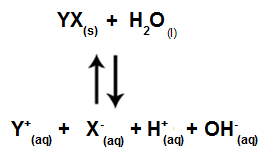
משוואה המציגה את כל היונים הקיימים בתמיסה
לסיכום, מכיוון שיוני המלח אינם מתקשרים עם יוני המים, יוני המלח אינם מקדמים שום שינוי בתמיסה הסופית. לפיכך, אנו יכולים לכתוב את המשוואה של הידרוליזת מלח בין חומצות חזקות לבסיסים חזקים רק עם משוואת יינון המים.
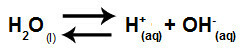
משוואה המייצגת הידרוליזה של חומצות ובסיסים חזקים
ד) דוגמה להידרוליזת מלח בין חומצות חזקות לבסיסים
כאשר אנו מוסיפים את מלח האשלגן כלור למים (KClO3), המלח מתנתק ומשחרר את קטיון האשלגן (K+) ואת אניון הכלור (ClO3-) באמצע.
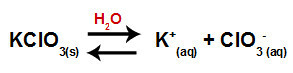
משוואת דיסוציאציה לאשלגן כלור
חשוב לזכור כי מים עוברים יינון עצמי ומספקים למדיום קטיון הידרוניום (H+) ואניון הידרוקסיד (OH-). כעת עלינו להעריך את האינטראקציה בין יונים מלח ומים.
כאשר ה- H+ מתקשר עם ClO3-, הוא יוצר חומצה פרוכלורית (HclO3). מכיוון שחיסור מספר החמצן במספר המימנים המיוננים בחומצה פרוכלורית הוא 2, הוא חזק. לכן, האינטראקציה בין היונים אינה מתרחשת.
כאשר הקטיון K+ מתקשר עם אניון ה- OH-, יש לנו היווצרות של בסיס חזק, שכן אשלגן הוא מתכת אלקלית. לכן, האינטראקציה בין היונים אינה מתרחשת.
המשוואה המייצגת את הידרוליזת המלח בין חומצות חזקות לבסיסים מהתמוססות של אשלגן כלור במים היא:
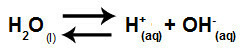
משוואה כימית של הידרוליזה של אשלגן כלור
על ידי. דיוגו לופס דיאס
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
DAYS, דיוגו לופס. "הידרוליזה מלוחה בין חומצות חזקות לבסיסים חזקים"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. גישה אליו ב -28 ביוני 2021.
כִּימִיָה

בדוק את הידע שלך ולמד עוד ברשימה זו של תרגילים נפתרים על איזונים כימיים. באמצעות חומר זה תוכלו להבין טוב יותר כיצד לעבוד על קבועי שיווי משקל (Kp, Kc ו- Ki), שינוי שיווי משקל, pH ו- pOH, כמו גם שיווי משקל במה שמכונה פתרונות חיץ.