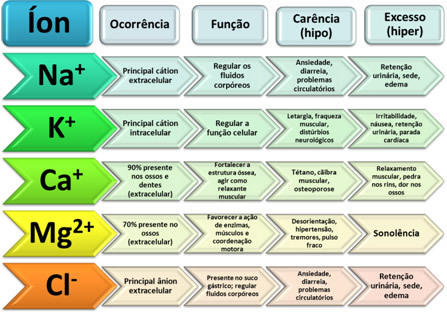
מומס וממס הם שני המרכיבים של תערובת הומוגנית הנקראת תמיסה כימית.
- מומס: הוא החומר המפוזר בממיס. זה תואם את החומר שיתמוסס, ובדרך כלל מציג את עצמו בכמות קטנה יותר בתמיסה.
- מֵמֵס: הוא החומר שבו מומס המומס ליצירת מוצר חדש. הוא מציג את עצמו בכמות גדולה יותר בפתרון.
פירוק בין המומס (המפוזר) והממיס (המפיץ) מתרחש באמצעות אינטראקציות בין המולקולות שלהם.
ההבדל בין שני מרכיבי התמיסה הוא שהמומס הוא החומר שיתמוסס והממיס הוא החומר שישפיע על פירוק.
הממיס הידוע ביותר הוא מים, הנחשבים ל ממס אוניברסלי. הסיבה לכך היא שיש לו את היכולת להמיס כמות גדולה של חומרים.
דוגמאות ממס וממס
ראה כמה דוגמאות לפתרונות כימיים וגלה את המומסים והממיסים של כל אחד מהם:
מים ומלח
- מומס: מלח שולחן - נתרן כלורי (NaCl)
- ממס: מים
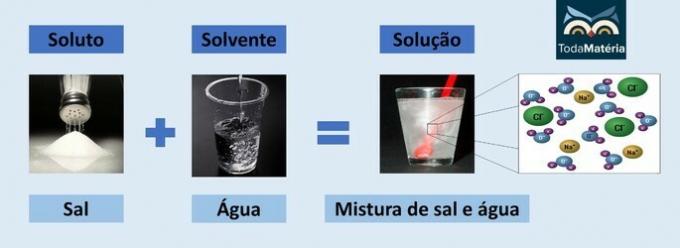
מכיוון שמדובר בתרכובת יונית, הנתרן כלורי בתמיסה מתנתק ויוצר יונים, שבתורם, נמסים על ידי מולקולות של מים.
קוטב המים החיובי (H+) מתקשר עם אניון המלח (Cl-) וקוטב המים השלילי (O2-) מתקשר עם הקטיון (Na+).
זהו סוג של תמיסה אלקטרוליטית, שכן המינים היוניים בתמיסה מסוגלים להוביל זרם חשמלי.
מים וסוכר
- מומס: סוכר - סוכרוז (ג12ה22או11)
- ממס: מים

סוכר הוא תרכובת קוולנטית וכאשר הוא מומס במים מולקולות הם מתפזרים אך אינם משנים את זהותם.
תמיסה מימית זו מסווגת כלא אלקטרוליטית, שכן המומס המפוזר בתמיסה הוא ניטרלי ולכן אינו מגיב עם מים.
חומץ
- מומס: חומצה אצטית (CH3COOH)
- ממס: מים

חומץ הוא תמיסה המכילה לפחות 4% חומצה אצטית, א חומצה קרבוקסילית בהיותם קוטביים, מתקשרים עם מים, גם קוטביים, באמצעות קשרי מימן.
כלל חשוב למסיסות הוא שכמו מתמוסס כמו. תרכובות קוטביות מומסות בממיסים קוטביים, ואילו חומרים לא קוטביים מתמוססים בממיסים לא קוטביים.
פתרונות אחרים
בנוסף לתמיסות נוזליות, ישנם גם תמיסות גזיות ומוצקות.
האוויר שאנו נושמים הוא דוגמה לתמיסה גזית, שהגזים בכמות גדולה יותר הם חנקן (78%) וחמצן (21%).
בְּ סגסוגות מתכת הם פתרונות מוצקים. לדוגמא, פליז (אבץ ונחושת) הוא תערובת המשמשת לייצור כלי נגינה.
רוצים לצבור יותר ידע? אז קרא את הטקסטים האחרים האלה:
- פתרונות כימיים
- כוחות בין-מולקולריים
- תערובות הומוגניות והטרוגניות
מהו מקדם המסיסות?
מקדם המסיסות הוא גבול המומס שנוסף לממיס בטמפרטורה נתונה ליצירת תמיסה רוויה.
או מקדם מסיסות משתנה בהתאם לתנאים, ויכול להגדיל או לרדת בהתאם לשינויי הטמפרטורה והמומס המדובר.
יש גבול שבו הממס יכול לבצע פירוק.
דוגמא: אם תשים סוכר בכוס מים, ברגע הראשון, תבחין שהסוכר נעלם במים.
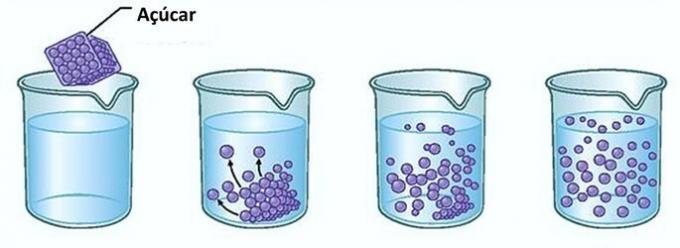
עם זאת, אם תמשיכו להוסיף סוכר, תגלו שבשלב מסוים הוא יתחיל להצטבר בתחתית הכוס.
הסיבה לכך היא שהמים, שהם הממיס, הגיעו לגבול של מְסִיסוּת וכמות הריכוז המקסימלית. נקרא המומס שנותר בתחתית המיכל ואינו מתמוסס גוף רקע.
עודף סוכר בתחתית הכוס לא יתמוסס ולא ישפיע על ריכוז התמיסה. יתר על כן, הסוכר המופקד בתחתית הכוס לא יהפוך את המים למתוקים יותר.
סיווג פתרונות
ניתן לסווג פתרונות לפי כמות המומס המומס. לפיכך, הם יכולים להיות משלושה סוגים: רווי, בלתי רווי ועל-רווי.
- פתרון רווי: הפתרון הגיע לגבול מקדם המסיסות, כלומר יש כמות מקסימלית של מומס המומס בממיס בטמפרטורה מסוימת.
- פתרון בלתי רווי: כמות המומס המומס טרם הגיעה למקדם המסיס. המשמעות היא שניתן להוסיף עוד מומס.
- פתרון על-רווי: יש יותר מומס מומס מאשר בתנאים רגילים. במקרה זה הם מציגים משקעים.
כדי ללמוד עוד על פתרונות, קרא את הטקסטים הבאים.:
- דילול פתרונות
- מולאליות
- מולאריות
- טיטרציה
ריכוז פתרונות
מהמומס והממיס ניתן לחשב את ריכוז התמיסה.
ריכוז משותף מוגדר כיחס המסה המומסת המומסת בנפח נתון של תמיסה.
חישוב הריכוז נעשה באמצעות הנוסחה הבאה:
להיות,
Ç: ריכוז (גרם / ליטר);
M: מסת המומס (g);
ו: נפח תמיסה (L).
דוגמא:
(Faap) חשב את הריכוז, בגר"ג, של תמיסה מימית של נתרן חנקתי המכיל 30 גרם מלח ב -400 מ"ל תמיסה:
פתרון הבעיה:
שימו לב למידע הנוגע לכמויות המומס והממיס. יש 30 גרם מלח (מומס) ב -400 מ"ל תמיסה מימית (ממס).
עם זאת, הנפח הוא במ"ל ועלינו להפוך אותו ל- L:
עכשיו, כדי לדעת את הריכוז, אתה רק צריך ליישם את הנוסחה:
עם תוצאה זו הגענו למסקנה שכאשר נערבב 30 גרם מלח עם 400 מ"ל מים, נקבל פתרון בריכוז 75 גרם / ליטר.
למידע נוסף על אופן חישוב הריכוז המשותף, טקסטים אלה יעזרו.:
- ריכוז פתרון
- תרגילים על ריכוז משותף