סובלימציה היא שינוי ממצב מוצק למצב גזי ולהיפך, מבלי לעבור את המצב הנוזלי.
כדי שחומר יעבור את תהליך הסובלימציה, עליו להיות נתון לערכים מסוימים של טמפרטורה ולחץ.
כדורי עש ו CO2 מוצק (קרח יבש) הם דוגמאות לחומרים העוברים סובלימציה בתנאי סביבה.

תרשים שלבים
אנו יכולים לגלות את מצבו הפיזי של חומר על ידי ידיעת ערכי הטמפרטורה והלחץ אליהם הוא נתון.
לשם כך אנו משתמשים בדיאגרמות שנבנו עבור כל חומר, מערכים שנמצאו בניסוי.
שקוראים לו "תרשים שלבים", הוא מחולק לשלושה אזורים המייצגים את המצבים המוצקים, הנוזליים והגזיים. הקווים התוחמים אזורים אלה מסמנים את הנקודות בהן החומר משנה שלב.
הנקודה המשולשת בתרשים מציינת את הטמפרטורה והלחץ שבהם יכול החומר להתקיים יחד בשלושת השלבים. מתחת לנקודה זו נמצאת עקומת הסובלימציה.
הנקודות בעקומה זו קובעות את ערכי הלחץ והטמפרטורה שבהם תתרחש סובלימציה.
כאשר מוצק מופעל ללחץ פחות מנקודת המשולש, אם הוא מחומם הוא יעבור ישירות למצב גזי.
השינוי ממצב מוצק ישיר למצב גזי יכול לקרות גם על ידי הפחתת הלחץ כאשר הטמפרטורה שלו נמוכה מזו של הנקודה המשולשת.
למידע נוסף באתר: שינויים במצב הפיזי.
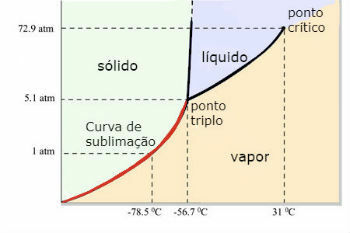
תרשים שלב של פחמן דו חמצני (CO)2 )
נקודת המשולש של CO2 מתרחשת כאשר הלחץ הוא 5 atm. עובדה זו מצדיקה כי מקובל לראות הופעת סובלימציה בקרח יבש, מכיוון שלחץ הסביבה הוא אטמוספרה אחת.
מסיבה זו, פחמן דו חמצני נוזלי אינו מתקבל בתנאי סביבה. בתנאים אלה, הוא נמצא במצב מוצק או במצב אדים.
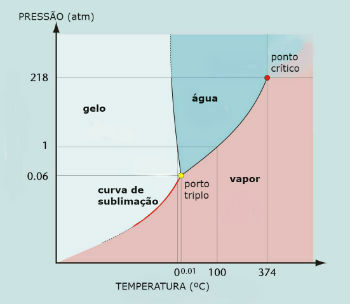
תרשים שלב מים (H2O)
נקודת המשולש של המים מתרחשת כאשר הלחץ הוא 0.06 atm בלבד. לפיכך, בתנאי הסביבה לא מקובל שהמים סובלים.
למידע נוסף, קרא גם:
- מצבים פיזיים של מים
- מצבים פיזיים של חומר
- נזילות או עיבוי
- מאפייני חומר
- התמצקות
- היתוך
- הִתאַדוּת
- רְתִיחָה
- אידוי