או קרן אטומית של אלמנטים הוא מאפיין תקופתי הקובע את רדיוס האטום המשתנה בהתאם למיקום היסוד בטבלה המחזורית.
לפיכך, הם יכולים להגדיל ולרדת ככל מספר אטומי (Z) של היסוד המתאים למספר הפרוטונים הקיימים בגרעין האטומים.
לסיכום, הרדיוס האטומי מתאים למחצית המרחק בין הגרעינים של שני אטומים שכנים, המתבטא באופן הבא:
r = d / 2
מֵאֵין:
ר = רדיוס
ד = מרחק גרעיני
באופן כללי, הרדיוס האטומי נמדד בפיקומטרים (pm), תת מכפלת של המטר (פיקומטר אחד = 10-12 M.). שימו לב שכאשר ההתייחסות אינה אטום אלא יון, הרדיוס שנמצא הוא הרדיוס היוני.
וריאציה של רדיוס אטומי
בטבלה המחזורית ניתן לראות את הצמיחה של רדיוס האטום באיור הבא:
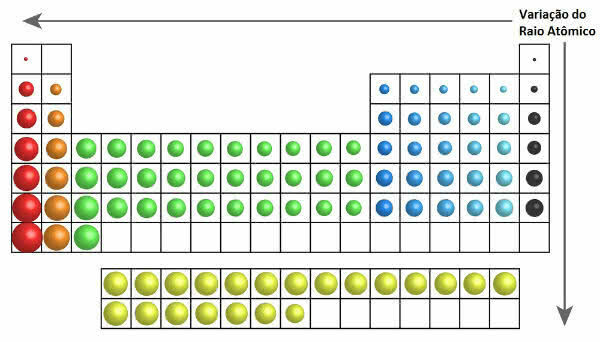 וריאציה של רדיוס אטומי בטבלה המחזורית
וריאציה של רדיוס אטומי בטבלה המחזורית
לפיכך, אנכית (משפחות או קבוצות) רדיוס האטום עולה מלמעלה למטה. על האופקי (תקופות), הם גדלים מימין לשמאל.
ראה את הווריאציה ההפוכה ב- זיקה אלקטרונית ו שליליות אלקטרונית.
אנרגיית יינון
ה אנרגיית יינון (או פוטנציאל) זהו גם תכונה תקופתית הקובעת את האנרגיה הנדרשת להעברת אלקטרון, המתבטאת בוולטים אלקטרוניים (eV).
קרא גם: מאפיינים תקופתיים.
בדוק את שאלות בחינת הקבלה עם החלטה שהגיבה ב: תרגילים על הטבלה המחזורית.