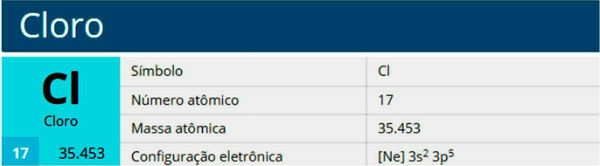
כלור הוא יסוד כימי עם הסמל Cl, מספר אטומי 17, מסה אטומית 35.5. הוא שייך למשפחת ההלוגן, קבוצה 17 או 7A, ולתקופה השלישית בטבלה המחזורית.
שמו נובע מהיוונית כלורוס, שפירושו ירקרק. הסיבה לכך היא שבתנאים רגילים של טמפרטורה ולחץ, כלור מאופיין כגז ירקרק-צהוב עם ריח עז.
תכונות
כלור התגלה בשנת 1774 על ידי המדען השבדי קרל וילהלם שילה (1742-1786). עם זאת, באותה תקופה האמנתי שמדובר בתרכובת עם חמצן. בשנת 1810, האמפרי דייווי (1778-1829) הוכיח שמדובר ביסוד כימי חדש.
מכיוון שמדובר באלמנט תגובתי ביותר, הוא כמעט ולא נמצא בטבע בצורתו הטהורה, למעט הכמות הקטנה הנפלטת במהלך התפרצויות געש בצורת HCl.
לפיכך, הוא נמצא בדרך כלל בצורה של נתרן כלורי (NaCl), המכונה גם מלח שולחן. במינרלים הוא מופיע בצורת קרנליט וסילוויט.
ניתן להשיג זאת גם באמצעות הַפרָדָה חַשְׁמָלִית של NaCl, בתמיסה מימית. כלור מייצר גם מלחים רבים מכלורידים בתהליך חִמצוּן.
למידע נוסף, קרא גם:
- טבלה מחזורית
- יסודות כימיים
- הלוגנים
יישומים
גז כלור (Cl2) רעיל ומעצבן, מצב זה הוביל לשימוש בכלי נשק כימי במהלך מלחמת העולם הראשונה. גז זה גורם לגירוי בדרכי הנשימה ובעור, אגירת מים בריאות, קריעה וכאשר הוא נשאף בכמויות גדולות עלול לגרום למוות.
כמה שימושים אחרים בכלור הם:
- הלבנת נייר ובדים באמצעות כלור דו חמצני (ClO2).
- טיפול במים, תוספת של כלור הופכים את המים לשתיה וכשירים למאכל אדם. תהליך זה נקרא כלורציה ומשתמש בחומצה היפוכלורית (HClO).
- חיטוי מי בריכות ופסולת תעשייתית, מכיוון שכלור מסוגל להרוג מיקרואורגניזמים.
- ייצור של תרכובות פלסטיק כגון PVC (פוליוויניל כלוריד) וגומי סינתטי.
- ייצור של כמה סוגים של תרכובות אורגניות ואורגניות.