איזוןתֶרמִי הוא המצב בו הגוף נמצא בתוך אותוטֶמפֶּרָטוּרָה מסביבתם. נצפה כי כל הגופים בטמפרטורות גבוהות משכניהם נוטים לתת להם חום באופן ספונטני עד ששניהם מתחילים להציג את אותה הטמפרטורה.
תראהגַם:יסודות התרמולוגיה
שיווי משקל תרמי וחוק האפס של התרמודינמיקה
שיווי משקל תרמי הוא המושג המרכזי העומד מאחורי החוק האפס של התרמודינמיקה. חוק כזה קובע כי במקרה של שתי מערכות תרמודינמיות, ה ו ב, נמצאים בשיווי משקל תרמי עם מערכת תרמודינמית שלישית, Ç, לאחר מכן, ה ו ב הם יהיו גם בשיווי משקל תרמי.
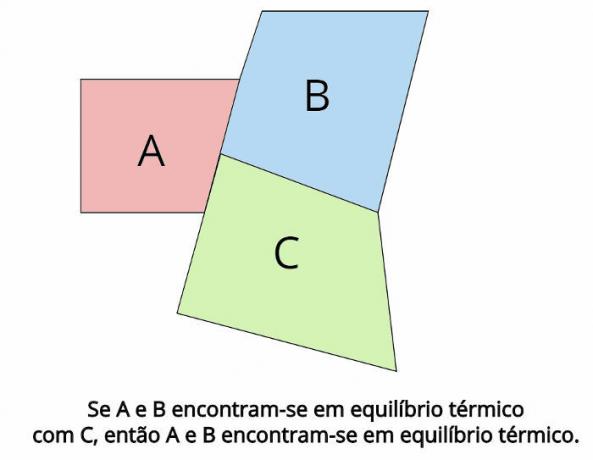
בשיווי משקל תרמי, הטמפרטורות הסופיות של כל גוף חייבות להיות שוות: Tה = Tב = TÇ
בדוק מה קובע המשפט של אפס החוק של התרמודינמיקה:
“אם שני גופים נמצאים בשיווי משקל תרמי עם גוף שלישי, אז הגופים האלה יהיו בשיווי משקל תרמי זה עם זה. "
דרך נוספת להבין איזון תרמי מבוססת על האנרגיה הפנימית של הגופים. אנרגיה פנימית, או פשוט אנרגיה תרמית, היא כמות פיזית באופן ישיריַחֲסִי à טֶמפֶּרָטוּרָה של הגוף. לכן, אם יש גופים עם טמפרטורות שונות בתוך אותה מערכת תרמודינמית, יהיו להם מודולים שונים של אנרגיה פנימית ולכן תעביר חלק מהאנרגיה ביניהם עד שלא יהיה הבדל בין האנרגיות שלהם. פְּנִימִי. האם אתה רוצה לדעת יותר על מהי אנרגיה פנימית ומה התכונות שלה? גש למאמר:
אנרגיה פנימית.אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
איזון חום ותרמי
העברת חום מתרחשת תמיד באופן ספונטני, מהגוף עם הטמפרטורה הגבוהה ביותר לגוף עם הטמפרטורה הנמוכה ביותר. העברת אנרגיה זו בצורת חום יכולה להתרחש בתהליכים כגון נְהִיגָה, הולכת חום ו קְרִינָה.
נְהִיגָה: העברת החום בין גופים מתרחשת במיוחד במוצקים. בהולכה מסוג זה, לא מתרחשות העברות המוניות. סוג זה של העברת חום מסביר כיצד שיווי משקל תרמי מתרחש למשל במתכות.
הולכת חום: זהו העברת חום המתרחשת בנוזלים. במצב זה של העברת חום, יש העברת מסה, כאשר הנוזל המחומם נע, ויוצר זרמי הסעה עד שכל הנוזל מגיע לשיווי משקל תרמי.
קְרִינָה: זהו העברת חום דרך גלים אלקטרומגנטיים, ולכן תהליך זה מתרחש גם אם אין מדיום פיזי בין הגוף לגוף אחר בטמפרטורות שונות. החום המועבר, במקרה זה, שווה ערך לגלים אלקטרומגנטיים עם פחות אנרגיה מאשר אור גלוי, ובכך להיות קרינה תרמית, הממוקם באזור אינפרא אדום.
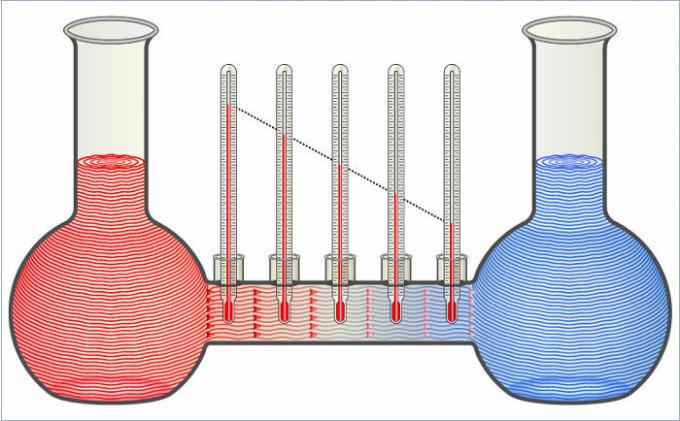
שני הנוזלים באיור מעבירים חום זה לזה עד שהטמפרטורות שלהם שוות.
האם אתה רוצה לדעת יותר על האופן בו כל אחד מתהליכי העברת החום מתרחש? גש למאמר: תהליכי התפשטות חום.
חום הגיוני
כשיש הֶבדֵלבטֶמפֶּרָטוּרָה בין שני גופים, או בין גוף וסביבתו, תהיה חילופי חום ביניהם באופן ספונטני, כך שה- גוף בטמפרטורה גבוהה יותר מתקרר, וגופים בטמפרטורה נמוכה יותר מתחממים עד שכולם מגיעים לטמפרטורה ב איזוןתֶרמִי.
כמות החום המוחלפת בין גופים בטמפרטורות שונות נקראת חום הגיוני ניתן לחשב סכום זה מהנוסחה המוצגת באיור להלן:
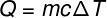
ש - חום (סיד או J)
M - מסה (גרם או ק"ג)
ç - חום ספציפי (cal / gºC או J / kg. K)
ΔT - שינויי טמפרטורה (° C או K)
בנוסחה המוצגת לעיל, חשוב להדגיש את גודל השם חום ספציפי. גודל כזה מודד את כמות האנרגיה למסה שחומר צריך להניב, או לספוג, כדי שהטמפרטורה שלו תשתנה ב -1 מעלות צלזיוס. במקרה של מים טהורים, למשל, ובתנאי לחץ רגילים, כדי לשנות את הטמפרטורה שלהם ב -1 מעלות צלזיוס, יש צורך ב 1.0 קלוריות לכל גרם מים.
לפיכך, כל החומרים אשר יצרו מגע תרמי זה עם זה נוטים להגיע למצב של איזוןתֶרמִי עם הזמן באופן ספונטני, לעומת זאת, חלקם דורשים כמות גדולה יותר של אנרגיה לשם כך וזה משפיע ישירות על הטמפרטורה כדי להגיע לשיווי משקל תרמי.
לקרואגַם:מהי טמפרטורה?
חום סמוי
יתכן שבמהלך חילופי חום עם סביבתו, הגוף מציג לחץ, טמפרטורה ונפח הגורמים לו לעבור שינוי במצבו הפיזי. שינויים אלה מתרחשים ב טֶמפֶּרָטוּרָהקָבוּעַ (לגופים המורכבים מחומר בודד, ללא זיהומים), כלומר למרות קבלת או מתן חום לסביבה החיצונית, הטמפרטורה של גופים אלה אינה משתנה.
זה אפשרי רק מכיוון שכל האנרגיה המוחלפת, במקרה זה, משמשת לשינוי הקונפורמציה של המולקולות שלך. מרגע ש"התגבר "על מחסום האנרגיה וכל תכולת הגוף במצב פיזי אחר, ה הגוף ממשיך להחליף חום עם סביבתו, אלא אם כן, כמובן, הטמפרטורה שלו שווה לטמפרטורה בחוץ.
או חום סמוי ניתן לחשב מהנוסחה המוצגת באיור למטה, בדוק זאת:
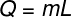
ש - חום סמוי (סיד או J)
M - מסה (גרם או ק"ג)
ל - חום סמוי ספציפי (cal / g או J / kg)
נוסחת שיווי משקל תרמי
במקרה שנרצה לגלות מהו טֶמפֶּרָטוּרָהבאיזון של מערכת תרמודינמית כלשהי, יש צורך שנראה את המערכת המדוברת כ- מערכתמְבוּדָדכלומר, עלינו להניח כי לא מוחלפת כמות חום עם שכונות המערכת הזו.
ממצב זה, אנו יכולים לומר כי כל כמות החום המוחלפת מוחלפת רק בין הגופים המרכיבים מערכת זו, התעלמות מאיבודי חום לקירות המכולה, למשל. במקרה זה אנו אומרים שיש למיכל יכולת תרמית זניח, כלומר הוא אינו סופג שום חום.
דמיינו את המצב הבא: בכוס תה חם, עם יכולת חום זניחה, שפכו כמה קוביות קרח. על מנת לקבוע את טמפרטורת שיווי המשקל התרמית, בנוסף להכרת התנאים הראשוניים של המערכת, עלינו לשקול כמה שיקולים:
כל כמות החום שנותן התה החם לקרח תיספג במלואו, מכיוון שלכוס יכולת חום זניחה.
עלינו להתעלם מאיבודי חום באוויר ובכל סביבה אחרת, כדי שניתן יהיה להבין את כוס התה הזו כמערכת תרמודינמית סגורה.
בדרך זו אנו יכולים לקבוע כי כל כמות החום שקיבל הקרח הוותרה על ידי התה החם, ובכך כתבנו את הנוסחה שלנו לחישוב האיזון התרמי:
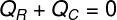
שר - חום שהתקבל
שÇ - חום נתון
החום שניתן (שÇ), מתייחס לכמות החום שהתה החם העביר לקוביות הקרח שהוחדרו בו. כבר החום שהתקבל (שר) הוא כמות החום שקיבלו קוביות הקרח. לכמות החום הזו יהיו שני אופי: חום רָגִישׁ וחם חָבוּימכיוון שכדי להיכנס לשיווי משקל תרמי, קוביות הקרח יתמוססו ככל הנראה.
קביעת טמפרטורת שיווי המשקל התרמי
בואו נקבע את טמפרטורת שיווי המשקל התרמית מהמצב הבא:
כוס, בעלת יכולת תרמית זניחה, המכילה 200 מ"ל (200 גרם) תה בטמפרטורה התחלתית של 70 מעלות צלזיוס, מקבלת 10 גרם קרח בטמפרטורה של -10 מעלות צלזיוס. קבע את טמפרטורת שיווי המשקל התרמית של המערכת (נניח שהחום הספציפי של התה שווה לחום הספציפי של המים):
נתונים:
çמים = 1.0 קלוריות / גרם מעלות צלזיוס
çקרח = 0.5 קלוריות / גרם מעלות צלזיוס
לקרח = 80 קלוריות / גרם
ראשית, אנו רואים כי כל החום שקיבל הקרח נמסר על ידי התה:

לאחר מכן, יש צורך לפרט אילו צורות של חום ניתנו וקיבלו:
תה: התה נתן חום הגיוני בלבד (שס), מכיוון שמצבו הגופני לא השתנה.
קרח: הקרח היה בתחילה ב -10 מעלות צלזיוס, כך שהוא קיבל חום הגיוני (שס) עד לטמפרטורה של 0 ºC ואז קיבל חום סמוי (Qל) לנזיל. לאחר שהפך נוזלי, הוא קיבל חום סמוי (שס) עד שהוא נכנס לשיווי משקל תרמי (TF) עם תה.
בתרגום מה שנותח לעיל בצורה של משוואה, יהיה לנו את החישוב הבא לפתור:
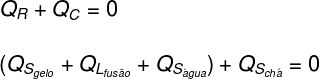
החלפת הנתונים שמספק התרגיל במשוואה שנמצאה לעיל, נצטרך לפתור את החישוב הבא:
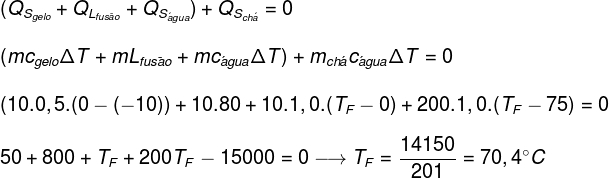
על פי החישוב שנעשה לעיל, טמפרטורת שיווי המשקל של מערכת התה + קרח צריכה להיות כ- 70.4 מעלות צלזיוס.
ניסוי באיזון תרמי
כדי לבדוק את האיזון התרמי בין שני גופים, אנו יכולים לבצע מספר ניסויים. הפשוט ביותר מבין אלה, כולל שימוש ב- קלורימטר זה מד טמפרטורה. הקלורימטר הוא מיכל אדיאבטי (שאינו מאפשר מעבר חום), בעל יכולת תרמית על אודותזניח, כמו סיר מרופד בקלקר, למשל, שהוא מבודד תרמי טוב.

הקלורימטר משמש למדידת טמפרטורת הטמפרטורה של המערכת בפנים.
איזון תרמי וחיים על פני כדור הארץ
או איזוןתֶרמִי זה ממלא תפקיד מהותי בחיים הארציים. ללא נוכחות של גזי חממה באטמוספירה של כדור הארץ, רובם קרינה תרמית של כדור הארץ יעזוב אותו, מתפשט לחלל. עם הזמן זה יגרום להתקררות מאסיבית על פני כדור הארץ ולגרום לאוקיאנוסים לקפוא עם הזמן.
בנוסף, לאוקיאנוסים תפקיד מרכזי ב איזוןתֶרמִי של כדור הארץ. מתוקף הגדולה שלה פסטה ו חוֹםספֵּצִיפִי, האוקיאנוסים ניחנים בענק קיבולתתֶרמִי, כלומר, הם צריכים לקבל כמויות אדירות של חום כדי לשנות את הטמפרטורה שלהם. מסיבה זו הם מסוגלים לווסת את טמפרטורת כדור הארץ ביעילות רבה. אזורים רחוקים מהאוקיאנוסים ועם מעט מים נוטים להיות גדולים טווחים תרמיים, כמו במקרה של מדבריות, שחמים מאוד ביום וקופאים בלילה.
לכן, ה איזוןתֶרמִי זהו תהליך בעל חשיבות מהותית לשמירה על תהליכים פיזיקלים, כימיים וביולוגיים על פני כדור הארץ, ולכן חיוני לקיומם של חיים על פני כדור הארץ.
על ידי. רפאל הלרברוק



