ה חוק מהירות התגובה מתייחס למהירות הטרנספורמציה הכימית לריכוזי ריאגנטים בכמות החומר (mol / L), אשר ניתן לומר כדלקמן:

לדוגמה, שקול את התגובה הגנרית הבאה:
aA + bB → cC + dD
בואו נגיד שאנחנו מגדילים את ריכוז המגיבים A ו- B, מה יקרה לקצב התגובה? ובכן, מכיוון שכמות החלקיקים המגיבים תגדל באותו חלל, יהיו התנגשויות יעילות יותר ביניהם, אשר יביאו לעלייה בקצב התפתחות התגובה. מה שאומר שזה יגביר את המהירות שלך.
לכן, קצב התגובה הוא ביחס ישר לריכוז המגיבים. עם זאת, זה תלוי גם בטמפרטורה. לכן, יש לנו את המשוואה המתמטית הבאה המייצגת את חוק מהירות התגובה:

על מה:
v = מהירות התגובה;
k = קבוע שתלוי רק בערך הטמפרטורה;
α ו- β = אקספוננטים שנקבעו בניסוי.
רק כאשר התגובה היא אלמנטרית, כלומר היא מתרחשת בצעד אחד, המעריכים שווים בדיוק למקדמים של המשוואה הכימית המאוזנת: v = k. [ה]ה. [B]ב. עם זאת, במקרים אחרים, יש לקבוע באופן ניסיוני את העוצמה המתאימה אליה יש להעלות את הריכוז של כל ריאגנט.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
חוק מהירות התגובות נקרא בשמות רבים, להלן כמה: חוק פעולה המונית, משוואת מהירות, חוק קינטיקה של תגובה וחוק גולדברג-וואג.
שקול דוגמה כיצד ליישם חוק זה:
שקול את התגובה האלמנטרית הבאה:
2 HCl (ז) → H2 (גרם) + קל2 (גרם)
א) כתוב את המשוואה למהירות התגובה הזו;
ב) באמצעות ניסויים, מהירות תגובת הפירוק של מימן כלוריד זה וריכוז מגיב זה, בטמפרטורה קבועה של 25 מעלות צלזיוס, צוינו בטבלה שלהלן:
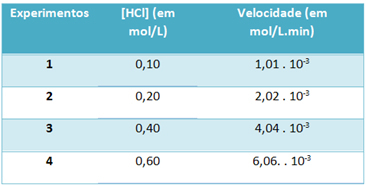
על סמך זה, קבע את קבוע המהירות האופייני לתגובה זו בטמפרטורה שהוזכרה.
פתרון הבעיה:
ה) v = k. [HCl]2
ב) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. ל-1. דקה-1
0.01 מול. ל-1
k = 1.01. 10-1 דקה-1
כדי לפתור את האות "ב", אתה יכול להשתמש בנתונים של כל אחד מהניסויים שהערך שהתקבל יהיה זהה.
אבל מה אם התגובה לא אלמנטרית? כיצד ניתן יהיה לפתור שאלות כאלה בתגובות לא אלמנטריות? כדי לברר כיצד קרא את חוק המהירות לתגובות שאינן אלמנטריות.
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "חוק מהירות התגובות הכימיות"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. גישה אליו ב -27 ביוני 2021.