ה ראשוןחוֹקנותןתֶרמוֹדִינָמִיקָה הוא יישום של עִקָרוֹןנותןשימורנותןאֵנֶרְגִיָה למערכות תרמודינמיות. על פי חוק זה, השונות של אנרגיה פנימית של מערכת תרמודינמית הוא ההבדל בין כמות חוֹם נקלט במערכת ובעבודה שנעשית על ידיה.
תראהגַם:מושגים בסיסיים וסיכום התרמולוגיה
מהו החוק הראשון של התרמודינמיקה?
החוק הראשון של התרמודינמיקה הוא תוצאה ישירה של העיקרון של שמירת אנרגיה. על פי עיקרון זה, האנרגיה הכוללת של מערכתתמיד נשאר קבוע, מכיוון שהיא לא אבודה, אלא הופכת.
בְּגֶדֶר תֶרמוֹדִינָמִיקָה, משומשים מושגים ספציפיים יותר ופחות כללי מאלה המשמשים בעקרון של שמירת אנרגיה. בחוק הראשון של התרמודינמיקה אנו משתמשים במושגים כמו אֵנֶרְגִיָהפְּנִימִי,חוֹם ו עֲבוֹדָה, הרלוונטיים להיקף מכונות תרמיות (יישומים טכנולוגיים בעלי חשיבות מהותית לתרמודינמיקה).

תארו לעצמכם מכונה המופעלת באמצעות קיטור, כאשר נוזל העבודה של אותה מכונה (אדי מים) מקבל חום ממקור חיצוני, שתי המרות אנרגיה אפשריות: לאדים יכול להיות משלו טֶמפֶּרָטוּרָה גדל בכמה מעלות או, אפילו, זה יכול לְהַרְחִיב להזיז את הבוכנות של אותה מכונה, ובכך לבצע כמות מסוימת של עֲבוֹדָה.
"השונות באנרגיה הפנימית של מערכת תרמודינמית תואמת את ההבדל בין כמות החום הנספגת בה לבין כמות העבודה שמערכת זו מבצעת."
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
נוסחת החוק הראשון של התרמודינמיקה
הנוסחה המשמשת לתיאור מתמטי של החוק הראשון של התרמודינמיקה מוצגת להלן:

U - וריאציה אנרגטית פנימית (cal או J)
ש - חום (סיד או J)
τ - עבודה (סיד או J)
על מנת להשתמש בנוסחה זו, עלינו לשים לב לכמה כללי איתות:
ΔU - יהיה חיובי אם טמפרטורת המערכת תעלה;
ΔU - יהיה שלילי אם טמפרטורת המערכת תפחת;
ש - יהיה חיובי אם המערכת סופגת חום מהסביבה החיצונית;
ש - זה יהיה שלילי אם המערכת תיתן חום לסביבה החיצונית;
τ – זה יהיה חיובי אם המערכת תתרחב ותבצע עבודות על הסביבה החיצונית;
τ – זה יהיה שלילי אם המערכת תתכווץ ותקבל עבודה מהסביבה החיצונית.
וריאציה אנרגטית פנימית
המונח ΔU מתייחס לשינוי האנרגיה המיוחס ל- אנרגיה קינטית של החלקיקים המרכיבים של המערכת, במקרה של גז אידיאלי, ניתן לומר כי ΔU שווה ערך ל:
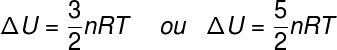
לא - מספר שומות (mol)
ר - קבוע אוניברסלי של גזים אידיאליים (0.082 atm.l / mol. K או 8.31 J / mol. K)
ט - טמפרטורה מוחלטת (קלווין)
בניתוח הנוסחאות, ניתן לראות שאם אין שינוי טמפרטורה במערכת, שלה אנרגיה פנימית גם יישאר ללא שינוי. יתר על כן, חשוב לומר כי עבור מכונות תרמיות הפועלות במחזורים, הווריאציה של האנרגיה הפנימית, בסוף כל מחזור, חייבת להיות אפסית, מכיוון שבאותה נקודה המנוע חוזר לפעול עם הטמפרטורה ההתחלתית.
תראהגַם:ביצועים של מכונות תרמיות: כיצד מחושבים?
חוֹם
במעבר למונח הבא, Q, המתייחס לכמות החום המועבר למערכת, אנו משתמשים בדרך כלל ב- משוואה בסיסית של קלורימטריה, המוצג להלן:
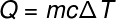
ש -מחמם (סיד או J)
M - מסה (גרם או ק"ג)
ç - חום ספציפי (cal / gºC או J / kg. K)
ΔT - וריאציה בטמפרטורה (צלזיוס או קלווין)
עֲבוֹדָה
האחרון בכמויות הקשורות לחוק הראשון של התרמודינמיקה הוא עבודה (τ), שיש לה a נוסחה אנליטית רק לתמורות המתרחשות בלחץ קבוע, ידועה גם כן כמו טרנספורמציות איזובריות, שעון:
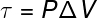
פ - לחץ (אבא או כספומט)
ΔV - וריאציית נפח (m³ או l)
כאשר הלחץ המופעל על המערכת אינו קבוע, ניתן לחשב את העבודה לפי שטח הגרף של לחץ מול נפח (P x V). למידע נוסף על גודל סקלרי זה, בקר בכתובת: עֲבוֹדָה.
תרגילים נפתרו
שאלה 1)(ספטMG) העבודה שבוצעה במחזור תרמי סגור שווה ל- 100 J, והחום הכרוך בחילופי תרמיות שווה ל- 1000 J ו- 900 J, בהתאמה, עם מקורות חמים וקרים.
מהחוק הראשון של התרמודינמיקה, הווריאציה של האנרגיה הפנימית במחזור תרמי זה, בג'אול, היא
א) 0
ב) 100
ג) 800
ד) 900
ה) 1000
פתרון הבעיה
חלופה א.
בואו נפתור את התרגיל באמצעות החוק הראשון של התרמודינמיקה, שימו לב:

על פי ההצהרה, אנו מתבקשים לחשב את הווריאציה של האנרגיה הפנימית במחזור תרמודינמי סגור, ובמקרה זה אנו יודעים כי וריאציית האנרגיה הפנימית חייבת להיות אפס, מכיוון שהמכונה תחזור לפעול באותה טמפרטורה שהייתה בתחילת המחזור.
שאלה 2)(UPF) דגימה של גז אידיאלי מתרחבת על ידי הכפלת נפחו במהלך טרנספורמציה איזוברית ואדיאבטית. בהתחשב בכך שהלחץ שחווה הגז הוא 5.106 אבא ונפחו הראשוני 2.10-5 אנו יכולים לומר:
א) החום הנספג על ידי הגז במהלך התהליך הוא 25 קלוריות.
ב) העבודה שעושה הגז במהלך התפשטותה היא 100 קלוריות.
ג) וריאציית האנרגיה הפנימית של הגז היא –100 J.
ד) טמפרטורת הגז נשארת קבועה.
ה) אף אחד מהאמור לעיל.
פתרון הבעיה
חלופה ג.
באמצעות מידע המסופק בהצהרת התרגיל, נשתמש בחוק הראשון של התרמודינמיקה כדי למצוא את החלופה הנכונה:
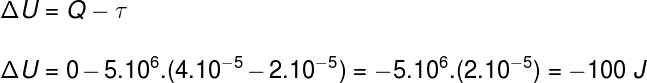
שאלה 3)(וואו) מיכל מטבח מכיל גז בלחץ גבוה. כשאנחנו פותחים את הצילינדר הזה, אנו מבחינים שהגז בורח במהירות לאטמוספרה. מכיוון שתהליך זה מהיר מאוד, אנו יכולים לראות בו תהליך אדיאבטי.
בהתחשב בכך שהחוק הראשון של התרמודינמיקה ניתן על ידי ΔU = Q - W, כאשר ΔU הוא השינוי באנרגיה בתוך הגז, Q הוא האנרגיה המועברת בצורה של חום ו- W היא העבודה שנעשית על ידי הגז, זה נכון אמר ש:
א) לחץ הגז גדל והטמפרטורה ירדה.
ב) העבודה על ידי הגז הייתה חיובית וטמפרטורת הגז לא השתנתה.
ג) העבודה שביצע הגז הייתה חיובית וטמפרטורת הגז ירדה.
ד) לחץ הגז עלה והעבודה שבוצעה הייתה שלילית.
פתרון הבעיה
חלופה ג.
ברגע שנפח הגז מתרחב אנו אומרים שהעבודה שבוצעה הייתה חיובית, כלומר הגז עצמו ביצע עבודות על הסביבה החיצונית. יתר על כן, מכיוון שהתהליך מתרחש במהירות רבה, אין זמן שהגז יחליף את החום עם הסביבה, ולכן מתרחש הדברים הבאים:
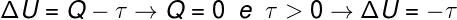
על פי החישוב, האנרגיה הפנימית של הגז פוחתת בכמות השווה לעבודה שנעשתה. בנוסף על ידי הגז, מכיוון שיש ירידה באנרגיה הפנימית של הגז, יש גם ירידה ב טֶמפֶּרָטוּרָה.
שאלה 4)(אודסק) במעבדה לפיזיקה נערכים ניסויים בגז שלצרכי ניתוח תרמודינמי יכול להיחשב גז אידיאלי. מניתוח אחד הניסויים, בו הועבר הגז לתהליך תרמודינמי, הגיעו למסקנה שכל החום שסופק לגז הומר לעבודה.
סמן את החלופה המייצגת נכונה התהליך התרמודינמי שבוצע בניסוי.
א) תהליך איזוו-וולומטרי
ב) תהליך איזותרמי
ג) תהליך איזוברי
ד) תהליך אדיאבטי
ה) תהליך מורכב: איזוברי ואיזובומטרי
פתרון הבעיה
חלופה ב.
כדי שכל החום המסופק לגז יומר לעבודה, אסור שתהיה ספיגה של אנרגיה פנימית על ידי במילים אחרות, הגז צריך לעבור תהליך איזותרמי, כלומר תהליך המתרחש בטמפרטורה קָבוּעַ.
מאת רפאל הלרברוק
מורה לפיזיקה
