פיזור מתייחס לתערובות באופן כללי. לדוגמא, כאשר אנו מערבבים מלח עם מים או מלח וחול אנו מקבלים שתי פיזורים. חומר שמתפשט, בצורה הומוגנית (כמו מלח במים) או הטרוגני (כמו חול במים), נקרא "מפוזר". לעומת זאת, מים משמשים כמפזרים במקרים אלה.
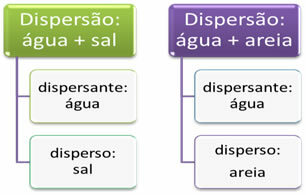
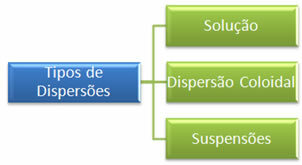
ההבדל העיקרי בין שני הפיזורים הללו הוא בגודל החלקיקים של הפיזור. בעוד שניתן לראות את גרגרי החול בעין בלתי מזוינת, חלקיקי המלח אינם נראים. על סמך זה ניתן לסווג פיזור לשלושה סוגים עיקריים, שהם:
שימו לב, בטבלה שלהלן, ההבדל בגודל החלקיקים המפוזרים:

* פתרונות: הם תערובות הומוגניות בהן איננו יכולים לראות את החלקיקים המפוזרים אפילו במיקרוסקופ. כמה דוגמאות הן המלח הנ"ל מהול במים וגם סוכר מהול במים.
במקרה של פתרונות, המפיץ נקרא מומס והמפיץ נקרא ממס. לא ניתן להפריד בין פתרונות בתהליך סינון כלשהו.
* פיזור קולואיד או קולואיד: כמה דוגמאות הן מיונז וג'לטין. חלקיקיו אינם מדמיינים בעין בלתי מזוינת, ולכן הם מבולבלים לעיתים קרובות עם מערכות הומוגניות, אך הם למעשה הטרוגניים, כפי שניתן לראות בשימוש במיקרוסקופים. חלקיקיו אינם מתיישבים עם פעולת הכבידה, אלא רק עם אולטרה-צנטריפוגות.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
ישנם מספר סוגים של פיזורים קולואידים, שהם: סול, סול מוצק, ג'ל, תחליב, קצף ותרסיס.
הפרדת פיזור מסוג זה אינה אפשרית באמצעות סינון, אלא עם קרום חדיר למחצה. חלקיקיו מחזירים ומפזרים אור.
* מתלים: הן מערכות הטרוגניות, בהן, אפילו בעין בלתי מזוינת, ניתן לדמיין את חלקיקיהן. כמה דוגמאות הן: חול במים, חימר במים, חלב מגנזיה וקלמין.
במקרה של פיזורים, האור מוחזר גם הוא. והפרדתו יכולה להיעשות על ידי סינון משותף.

* למרות שחלק מחברים וחוקרים הציעו כי לחלקיקים קולואידיים יש גודל בין 1 ל 100 ננומטר וכי המתלים הם יותר מ 100 ננומטר, ראיות ניסיוניות נוטות להגדיל ערך זה ל 1000 ננומטר, וערך זה הוא המקובל ביותר על ידי רוב מחברים. עם זאת, התנהגותה המקרוסקופית באמת תקבע אם התערובת קולואידלית או תלויה.
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "סוגי פיזור"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/tipos-dispersoes.htm. גישה אליו ב -28 ביוני 2021.


