IL equazione di Clapeyron è un'espressione matematica che mette in relazione quantità come pressione (P), volume (V), temperatura (T) e numero di particelle (n) che compongono a gas perfetto o ideale. Questa equazione prende il nome dal fisico francese PaoloemilioClapeyron e può essere inteso come una generalizzazione delle leggi empiriche della gasPerfettonelGay-Lussac, Charles e Boyle. Fu fondamentale per lo studio dei gas ideali e permise l'evoluzione di Macchine termiche, rendendoli sempre più efficienti negli ultimi decenni.
Vedi anche: Scoperte della fisica avvenute per caso By
Equazione di Clapeyron: legge dei gas ideali
L'equazione di Clapeyron è derivato da tre leggi empiriche, cioè leggi che sono state determinate da esperimenti. Tali leggi spiegano il comportamento dei gas in trasformazioni di gasisovolumetrico (legge Gay-Lussac), isobarico (legge di Charles) e isoterme (legge di Boyle). Secondo queste leggi:
nelle trasformazioni isovolumetrico, il rapporto tra pressione e temperatura termodinamica di un gas ideale rimane costante;
nelle trasformazioni isobarico, il rapporto tra il volume e la temperatura termodinamica di un gas ideale è costante;
- nelle trasformazioni isoterme, il prodotto tra pressione e volume di un gas ideale rimane costante.
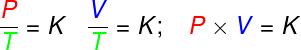
P – pressione (Pa – pascal)
V – volume di gas (m³)
T – temperatura del gas termodinamico (K – kelvin)
Dalle tre leggi sopra, l'equazione di Clapeyron determina quale sia il valore di questo costante (K) ottenuto in ciascuna delle suddette trasformazioni. Secondo l'equazione di Clapeyron, questa costante è uguale al numero di moli moltiplicato per a costante R, nota come costante universale dei gas ideali, e uguale a costante di Boltzmannmann moltiplicato per Il numero di Avogadro.
Formula
Scopri la formula che è conosciuta come equazionenelClapeyron:
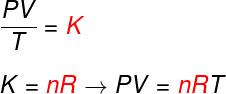
no – numero di moli (mol)
R – costante universale dei gas ideali (R = 0,082 atm.l/mol. K o 8,314 J.mol/K)
Analizzando l'equazione di Clapeyron, è possibile vedere che la pressione esercitata dai gas ideali è direttamente proporzionale alla temperatura e anche a numero di moli. Inoltre, la pressione è inversamente proporzionale al volume occupata dal gas.
oh modello del gas ideale reso possibile dall'equazione di Clapeyron è ampiamente utilizzato per il sviluppo di macchine alimentate da fluidi, come macchine a vapore e motori a combustione interna.
Diversi risultati importanti potrebbero essere ottenuti dall'equazione di Clapeyron. Uno di questi, ad esempio, prevede che 1 mole di qualsiasi gas ideale occupi un volume di 22,4 l quando sottoposto alla pressione di 1 atm (1,01.105 Pa) e alla temperatura di 273K (0°C).
Vedi anche: Concetti più importanti in termologia
Esercizi risolti sull'equazione di Clapeyron
Domanda 1 —(UECE) Un gas che può avere la sua temperatura, volume e pressione correlati da PV = nRT ha le seguenti caratteristiche:
a) distanza media molto grande tra le molecole per non tenere conto delle interazioni intermolecolari, tranne in caso di collisione; le molecole subiscono urti elastici.
b) distanza media molto piccola tra le molecole; molecole subiscono urti anelastici.
c) distanza media tra le molecole molto grande per non considerare le interazioni intermolecolari, tranne in caso di collisione; molecole subiscono urti anelastici.
d) distanza media tra le molecole molto grande e con forti interazioni intermolecolari; le molecole subiscono urti elastici.
Risoluzione:
Nel modello del gas ideale, un gran numero di particelle adimensionali si muove ad alta velocità in direzioni casuali. L'unica interazione subita da queste particelle sono gli urti perfettamente elastici, quindi l'alternativa corretta è lettera a.
Domanda 2 —(UFRGS) Considera le seguenti affermazioni sui gas ideali.
IO. La costante R presente nell'equazione di stato per i gas pV = nRT ha lo stesso valore per tutti i gas ideali.
II. Volumi uguali di gas ideali diversi, alla stessa temperatura e pressione, contengono lo stesso numero di molecole.
III. L'energia cinetica media delle molecole di un gas ideale è direttamente proporzionale alla temperatura assoluta del gas.
Quali sono corretti?
a) Solo io
b) Solo II
c) Solo III
d) Solo I e II
e) I, II e III
Modello:
Vediamo le alternative:
IO. corretta, quindi è chiamata la costante universale dei gas ideali.
II. corretta. Secondo l'equazione di Clapeyron, se due gas ideali hanno la stessa pressione, temperatura e volume, allora il numero di particelle in quei gas è uguale.
III. corretta. Secondo il teorema di equipartizione dell'energia, l'energia cinetica delle particelle in un gas ideale è proporzionale alla sua temperatura.
Pertanto, l'alternativa corretta è il lettera e.
Domanda 3 - (UFJF) Uomini come Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, tra gli altri, hanno sviluppato importanti studi sulle proprietà dei gas. Il comportamento dei gas reali si avvicina ai gas ideali in condizioni di bassa pressione, nonché ai gas contenuti in un grande volume e ai gas mantenuti ad alte temperature. Si consideri che, in un esperimento di laboratorio, un contenitore di volume V completamente chiuso e contenente 1 mole di gas ideale alla pressione di 4.0 atm è soggetto ad una espansione a temperatura costante pari a 127 ºC e che il comportamento di questo gas è quello di un gas ideale, come mostrato grafico.
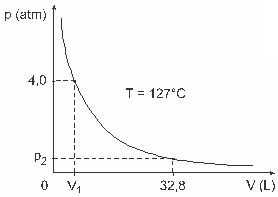
In questo caso, quando il gas occupa un volume pari a 32,8 L, la pressione da esso esercitata sarà:
(Dato: la costante universale dei gas perfetti è R = 0,082 atm. l/mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1.0 atm
d) 2.0 atm
e) 2,6 atm
Risoluzione:
lettera C
Per risolvere l'esercizio, dobbiamo applicare i dati all'equazione di Clapeyron, ma prima dobbiamo trasformare la temperatura, che è in gradi Celsius, in kelvin. Check-out:

Di Rafael Hellerbock
Insegnante di fisica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm
