Kc è l'acronimo che rappresenta la costante di equilibrio in termini di concentrazione di una particolare reazione chimica. Viene utilizzato ogni volta che si fa riferimento all'instaurazione o meno dell'equilibrio in una reazione chimica. Per questo è sempre necessario eseguire un calcolo del Kc, che utilizzi le concentrazioni in quantità di materia dei partecipanti alla reazione.
IL interpretazione Kc è molto semplice, perché quando:
Kc = 1, il sistema di reazione è in equilibrio;
Kc > 1, il sistema non è in equilibrio e la reazione diretta è predominante;
Kc < 1, il sistema non è in equilibrio e predomina la reazione inversa.
È importante sottolineare che l'interpretazione di Kc dipende dalla conoscenza dell'equilibrio chimico.
ne abbiamo uno equilibrio chimico quando una reazione chimica è reversibile, cioè presenta una reazione diretta (i reagenti formano i prodotti) e una reazione inversa (i prodotti formano i reagenti), e la velocità di reazione in avanti è esattamente la stessa della velocità di reazione inversa. Vedi un esempio:

Nell'esempio sopra, abbiamo un equilibrio chimico (indicato dalle due frecce), in quanto vi è a reazione diretta (A+B formando C+D) e il reazione inversa (C+D formando A+B). I coefficienti a, b, c, d rendono l'equazione equilibrata.
Ciascuno dei partecipanti a una reazione ha sempre un concentrazione in quantità di materia (mol/L). Con i valori di concentrazione possiamo calcolare il Kc della reazione. Tuttavia, per eseguire questo calcolo, è necessario assemblare l'espressione Kc.
L'assemblaggio dell'espressione Kc usa sempre lo stesso schema. Con questo schema, moltiplichiamo le concentrazioni di prodotti elevati ai rispettivi esponenti e divisi per la moltiplicazione dei reagenti elevati ai rispettivi esponenti.
L'espressione Kc per il saldo generico di seguito sarebbe:

Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Kc = [Ç]ç.[D]d
[IL]Il.[B]B
Nell'espressione di Kc, non usiamo mai partecipanti solidi o acqua liquida, poiché sono elementi costanti nella reazione.
Vedi alcuni esempi:
Esempio 1: Equilibrio della formazione di ammoniaca
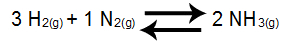
Nel saldo di cui sopra, il prodotto è NH3, che ha coefficiente 2, e i reagenti sono H2 poi2, che presentano, rispettivamente, i coefficienti 3 e 1. Tutti i partecipanti all'equilibrio sono gassosi, quindi possono far parte di Kc. Da questi dati, l'espressione Kc sarà:
Kc = [NH3]2
[H2]3.[N2]1
Esempio 2: Bilancio della decomposizione del carbonato di calcio
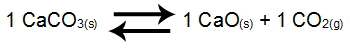
Nel saldo di cui sopra, i prodotti CaO e CO2e il reagente CaCO3avere coefficiente 1. Come CaCO3 e CaO sono solidi, non possono far parte di Kc. Da questi dati, l'espressione Kc di equilibrio sarà:
Kc = [CO2]1
NOTA: L'espressione non avrà denominatore perché il reagente è solido. Quindi, lasciamo l'espressione senza denominatore o mettiamo il numero 1 al denominatore (numero che indica la costanza di un partecipante).
Esempio 3: Bilancio della formazione di cloruro di ammonio
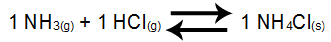
Nell'equilibrio di cui sopra, i reagenti NH3 e l'HCl e il prodotto NH4Cl ha coefficiente 1. In qualità di partecipante al saldo NH4Cl è solido, non può far parte di Kc. Da questi dati, l'espressione Kc di equilibrio sarà:
Kc = 1
[NH3]1.[HCl]1
NOTA: Non avendo al numeratore alcun saldo partecipante, è necessario inserire il numero 1 (numero che indica la costanza di un partecipante).
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Cos'è Kc?"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kc.htm. Consultato il 28 giugno 2021.
Che cos'è la chimica?

Comprendere cos'è Kp, la costante di equilibrio in termini di pressione, e sapere come ottenerla utilizzando le pressioni parziali di tutti i gas presenti in un equilibrio chimico, che può essere in atmosfere (atm) o millimetri di mercurio (mmHg). Clicca qui e scopri di più su questo argomento!
Chimica

Metti alla prova le tue conoscenze e impara di più con questo elenco di esercizi risolti sugli equilibri chimici. Attraverso questo materiale, sarai in grado di capire meglio come lavorare le costanti di equilibrio (Kp, Kc e Ki), lo spostamento dell'equilibrio, il pH e il pOH, nonché l'equilibrio nelle cosiddette soluzioni tampone.