La polarità delle molecole è un aspetto molto importante, poiché le caratteristiche delle sostanze sono determinate, tra gli altri fattori, dal fatto che le loro molecole sono polari o non polari.
La determinazione della polarità di una molecola può essere eseguita utilizzando il Momento dipolo o Momento di dipolo risultante, il cui simbolo è 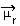 . Se stiamo parlando solo del momento di dipolo di ciascun legame nella molecola, allora il simbolo è la lettera greca mi (µ).
. Se stiamo parlando solo del momento di dipolo di ciascun legame nella molecola, allora il simbolo è la lettera greca mi (µ).

La molecola sarà non polare se il momento di dipolo è uguale a zero, ma se è diverso da zero, significa che è polare.

Ci sono due cose importanti da considerare nel determinare questo momento di dipolo risultante. Vediamo quali sono:
1) differenza di elettronegatività tra gli atomi degli elementi che partecipano alla reazione. Ad esempio, la molecola HF ha una marcata differenza di elettronegatività, poiché il fluoro attrae, molto più dell'idrogeno, la coppia di elettroni nel legame. Pertanto, la distribuzione delle cariche non è simmetrica, con dipoli elettrici.
Questo dipolo è rappresentato da un vettore rivolto verso l'estremità che concentra più elettroni, cioè dall'atomo meno a quello più elettronegativo. Quindi, in questo caso, il vettore, che è l'unico, sarà il vettore risultante, come indicato di seguito:
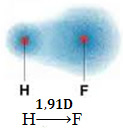
Notare che il valore del vettore è lo stesso del momento di dipolo, che è dato in unità di debye (D=3.33. 10-30 coulomb. metropolitana). Poiché il momento di dipolo è diverso da zero, la molecola e il legame sono polare.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
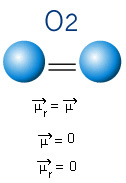
Nella molecola sottostante abbiamo anche una molecola con solo due atomi, però in questo caso corrisponde ad una sostanza semplice, cioè è composta da un solo tipo di elemento. Pertanto, non c'è differenza di elettronegatività; gli atomi attirano anche gli elettroni, che sono distribuiti simmetricamente. Il momento di dipolo risultante è uguale a zero, quindi sia il legame che la molecola sono apolare.
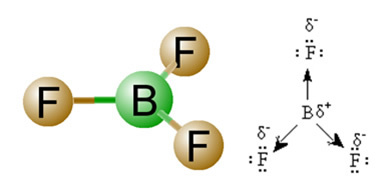
2) Geometria molecolare, cioè la disposizione spaziale dei vettori. La molecola BF3 ha tre legami polari, in cui il fluoro è il più elettronegativo, avendo così i vettori diretti verso di esso. Tuttavia, poiché la disposizione spaziale degli atomi è trigonale piatta, questo fa sì che gli elettroni abbiano una distribuzione simmetrica attorno all'atomo centrale. Quindi, il risultato è che questi tre vettori si annullano a vicenda e il momento di dipolo è uguale a zero. Pertanto, la molecola BF3 é apolate.
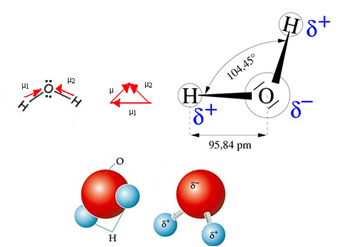
La molecola d'acqua ha due vettori, tuttavia, la sua geometria spaziale non è piatta, ma a forma di V. Si noti nella figura seguente che in questo modo i loro vettori non si annullano a vicenda, gli elettroni sono distribuiti asimmetricamente e più concentrati nell'atomo più elettronegativo, che è l'ossigeno. Quindi, il momento di dipolo è diverso da zero e la molecola d'acqua è polare:
di Jennifer Fogaça
Laureato in Chimica



